1. 서 론
볼밀링에 의한 고상반응법(이후 볼밀링 또는 MA로 표기)은 금속분말을 볼밀링함으로써 분말입자에 전위, 공공(vacancy), 격자변형 등 결정결함이 축적되고 분말을 초미세 입자로 분쇄하거나 합금화, 복합화시킬 수 있다. 또한 비정질상을 비롯한 비평형상의 창제수단으로서 학문적 뿐만 아니라 실용적인 측면에서 크게 주목받고 있다. 종래의 비평형상 제조방법인 액체급냉법이나 기상급냉법에서는 순간적으로 반응이 일어나는 반면 볼밀링에서는 결정상으로부터 생성상까지 긴 시간에 걸쳐 고상반응이 진행되어 그 중간과정을 관찰할 수 있다.1,2,3,4)
한편 볼밀링에서는 분말입자의 초미세화에 의하여 벌크체에서 보다 낮은 온도에서 산화나 환원 등 화학반응이 일어나기도 한다. 실제로 금속분말을 출발재료로 하여 볼밀링 공정을 적용한 무기재료의 제조, 표면효과를 이용한 반응속도의 고속화나 산화 및 환원반응 등의 예가 있다.5,6,7,8) 볼밀링 중 발생하는 화학반응을 이용하면 성분원소를 용융시키거나 하지 않아도 실온에서 고상반응을 통하여 직접 초미세 복합재료를 직접 제조할 수 있다.
볼밀링에 의한 고상반응의 경우 성분 원소의 반응열(reaction heat)이 부(-)로 비교적 큰 합금계에 대한 연구가 대부분이었다.7,8) 한편 볼밀링 공정을 적용하면 혼합엔탈피 ΔHmix > 0로 성분 원소의 화학적 결합력이 없는 비고용계에서도 고용합금이나 비결정질상이 제조될 수 있다.9) 실제로 Lee et al.9)은 ΔHmix = +2 kJ/mole인 비고용 Cu-Ta계의 볼밀링을 행하여 extended X-ray absorption fine structure (EXAFS), 중성자회절, 전자물성을 통하여 비정질화 과정을 보고하였다. 이것은 볼밀링에 의하여 원료분말의 자유에너지가 비정질상의 그것보다 높은 상태로 여기되어 반응이 진행하는 것을 의미한다. 즉 볼밀링 시 분말입자에 전위, 공공(vacancy), 격자 歪 등 결정결함의 축적을 통하여 고상 비정질화 반응이 진행되는 것이라고 하였다.10,11,12)
따라서 본 연구에서는 성분 원소의 반응열이 정(+)인 합금계를 선택하여 실온에서 볼밀링에 의한 고상반응 처리를 실시하였다. 합금계는 철산화물인 헤마타이트와 고상반응에 의한 환원 시 반응열이 정(+)이며 그 값이 2.23 kcal/mole로 비교적 작은 값을 가지는 철계로 하였다.13) 특히 볼밀링 처리된 시료에 대하여 볼밀링에 따른 결정구조 변화, 자기특성 및 승온에 따른 상변화를 조사하여 고상 환원반응에 미치는 볼밀링 효과를 명확히 밝히고자 하였다.
2. 실험 방법
본 연구에서는 Table 1에 나타낸 바와 같이 반응열이 정(+)인 계를 선택하여 고순도 화학제 Fe2O3 (99.9 % 평균입경 0.1 µm)와 Fe (99.9 % 평균입경 100 µm)을 출발원료로 몰비 Fe2O3 : Fe = 1.0 : 0.4, 0.6, 0.8, 1.0 조성이 되도록 각각 혼합하여 볼밀링을 실시하였다.13)
Table 1.
Chemical reaction heat related with the solid state reaction of hematite by Fe.
| Reaction | Q (kcal/mol) of oxygen atoms in the reaction products |
| Fe2O3 + Fe → 3FeO | +2.23 |
볼밀링은 Spex 볼밀장치(진동형)를 사용하였고, 용기는 볼밀링 중 분위기 가스로의 치환이 가능하도록 제조하여 고순도 Ar 분위기에서 행하였다. 볼밀용기 및 볼의 재질은 stainless steel로 하였다.
볼밀링한 용기를 Ar 분위기의 glove box 내에 넣어 시료를 채취하였다. 시료의 분석은 X선 회절시험(λ = 1.542Å, Rigaku, D/Max-2200), 열분석(Shimazu, DSC-50), 전자현미경(Hitachi, H-2010), 진동시료형자력계(Toei VSM5)을 사용하여 생성상, 분말 형상, 자기특성 변화를 조사함으로써 고상반응 과정을 조사하였다. Vibrating sample magnetometer (VSM)을 이용한 포화자화 값은 순 Ni로 자화 값을 보정한 후 자기장 5 kOe에서, 보자력 값은 magnetization-magnetic field (M-H) 곡선의 감자곡선에서 각각 측정하였다. X-ray diffraction (XRD) 분석은 모노크로메타가 장착된 장치를 이용하였으며, 정성분석의 경우 2θ = 10~90°에서 2°/min 고니오메타의 연속 스캔모드로, 정밀한 측정 시에는 step 스캔모드로 실시하였다. 볼밀링한 시료의 평균 결정립 크기는 XRD peak의 적분 반가폭(full width at half maximum, FWHM)으로부터 hall-plot에 의하여 계산하였다.14)
3. 결과 및 고찰
Fig. 1은 몰비 Fe2O3 : Fe = 1.0 : 0.4, 0.6, 0.8, 1.0 조성의 시료를 각각 5 h 동안 볼밀링하였을 때의 XRD 분석에 의한 상변화를 나타낸 것이다. Fe2O3 ‧ 0.4Fe 조성의 경우 5 h 볼밀링에 의하여 출발상인 Fe2O3, Fe와 함께 Fe3O4 및 FeO 상이 관찰되었다. 이것은 볼밀링 중 Fe2O3-Fe계의 반응열이 정(+)임에도 불구하고 고상 환원반응을 일으켜 생성된 것임을 알 수 있다. 또한 Fe양을 증가시킨 Fe2O3 ‧ (0.6-1.0)Fe 조성에서도 고상반응에 의한 환원 결과 Fe3O4 및 FeO 상이 생성되는데 잔존하는 출발상 Fe2O3 및 Fe의 차이를 보이며, 특히 Fe2O3 ‧ (0.9, 1.0)Fe 조성의 경우 큰 Fe의 회절 피크가 관찰되었다. 이것은 이 계에서 고상반응에 의한 환원 결과, FeO 생성을 위해서는 화학양론보다 적은 Fe 양이 필요한 것으로 생각된다. Fe2O3 ‧ 0.8Fe 조성의 경우 출발상 Fe가 가장 적게 잔존하고 FeO 생성이 뚜렷하여 실험조성 중 고상 환원반응이 가장 진행된 것으로 판단된다. 여기서 볼밀링에 의하여 생성된 Fe3O4 및 FeO는 볼밀링 중 분말입자에 전위, 공공(vacancy), 격자변형 등 결정결함의 축적에 의하여 회절선의 반가폭이 넓어지는 것으로 판단되며 매우 미세한 복합분말이 얻어졌음을 암시한다.11,12)
Fig. 2는 5 h 동안 볼밀링에 의하여 고상 환원반응이 가장 많이 진행된 Fe2O3 ‧ 0.8Fe 조성에 대하여 볼밀링 시간에 따른 상변화를 자세히 나타낸 것이다. 볼밀링 초기단계인 1 h에는 출발상인 Fe2O3, Fe와 함께 비자성 FeO상이 관찰되었다. 여기서 볼밀링 시간을 증가시키면 3 h 이후 강자성 Fe3O4 상이 생성되며 8 h 동안 볼밀링을 실시하면 FeO 상과 함께 소량의 Fe3O4, Fe가 잔존함을 알 수 있다. 이상의 결과로부터 Fe2O3-Fe계의 반응열이 정(+)임에도 불구하고 볼밀링 시 전위, 공공(vacancy), 격자변형 등 결정결함의 축적을 통하여 고상반응에 의한 환원이 진행됨을 알 수 있다.
Fig. 3은 Fe2O3 ‧ 0.8Fe 조성의 분말에 대하여 볼밀링 시간에 따른 SEM 관찰 결과를 나타낸 것이다. 볼밀링을 실시하기 전에는 Fig. 3(a)에서 볼 수 있듯이, Fe2O3 및 Fe가 단순히 혼합된 상태이며, 비교적 조대한 분말은 Fe 분말이며 미세한 분말은 Fe2O3임을 특성 X선 분석을 통해서 알 수 있었다. Fig. 3(b)는 1 h 동안 볼밀링한 시료의 형상을 보여주는 것으로, 입자가 큰 Fe 분말에 Fe2O3 분말이 응집되어 있고 일부 분쇄된 Fe 분말의 불균일한 모양을 하고 있다. 한편 볼밀링을 8 h 더 진행하면 모든 분말의 입자가 점점 균일하게 분산 및 미세화하며 평균 입자크기가 3 µm 정도의 복합분말이 관찰되었다. 여기서 입자가 큰 분말도 함께 존재하는데 이것은 균일하게 미세화된 입자가 서로 응집되어 형성된 것으로 볼밀링을 8 h 까지 더 진행하면 그 비율이 줄어들었다.
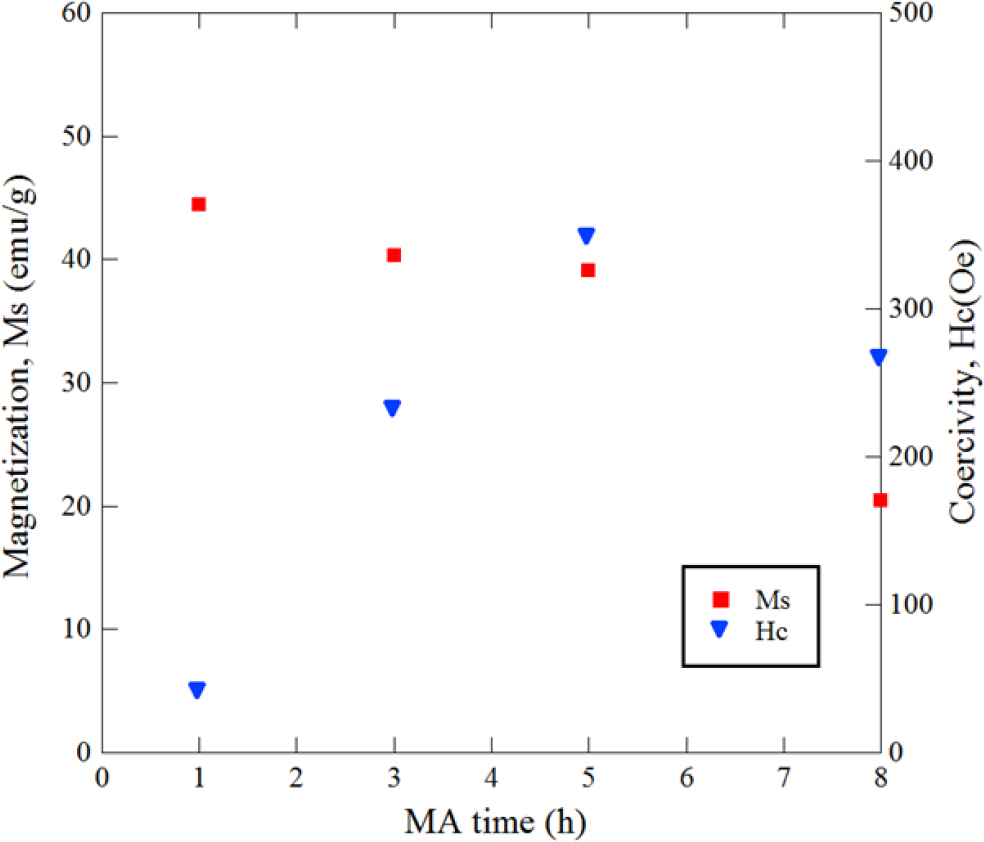
Fig. 4에는 Fe2O3 ‧ 0.8Fe 조성의 시료에 대하여 볼밀링에 의한 고상반응 시 자기특성 변화를 알아보기 위하여 볼밀링 시간에 따른 자기이력곡선의 변화를 나타낸 것이다. 또한 Fig. 4에서 측정된 포화자화 값, saturation magnetization (Ms) 및 보자력 값, coercivity (Hc)의 변화를 Fig. 5에 나타내었다. 볼밀링한 모든 Fe2O3 ‧ 0.8Fe 시료에서 강자성체의 특징인 뚜렷한 자기이력곡선이 관찰되며, 이것은 볼밀링 중 고상반응에 의하여 생성된 강자성 Fe3O4와 출발상 Fe가 잔존하고 있음을 나타내는 것이다. 여기서 볼밀링한 시료의 포화자화 값은 볼밀링 1 h에서 44 emu/g으로 최대 값을 보인 후 볼밀링 시간에 따라 감소하여 8 h 후에는 23 emu/g로 최소 값을 나타내었다. Ms 값은 고상반응에 의한 환원이 진행되며 출발상 Fe와 생성된 Fe3O4에 의한 것으로, 볼밀링 8 h 후에도 FeO와 함께 잔존하고 있음을 알 수 있으며 따라서 환원반응이 아직 완료되지 않은 것으로 판단된다.
볼밀링한 시료의 Hc는 볼밀링 시간에 따라 증가하여 5 h 시료에서 340 Oe로 최대 값을 나타낸 후 8 h 시료의 경우에는 오히려 270 Oe로 감소하였다. 이것은 환원반응에 의하여 생성되는 Fe3O4와 출발상 Fe의 결정립 크기가 초기에는 크며 또한 적은 결정결함을 가지기 때문인데, 5 h까지 계속 볼밀링을 실시하면 결정립은 작아지고 전위, 격자변형 등의 증가로 자기적 경화가 일어나며, 그 결과 큰 보자력 값이 얻어지는 것으로 판단된다.15,16)
Fe2O3 ‧ 0.8Fe 8 h 시료에 대하여 고상반응에 의한 환원 결과 생성된 FeO 상의 결정립 크기를 계산하기 Fig. 2 XRD 패턴을 이용하여 hall-plot을 실시하였다. 정확한 피크의 반가폭을 측정하기 위하여 표준시료로 광학계 보정을 실시한 후 적분 반가폭을 구했다. 그 결과 볼밀링을 8 h 동안 실시하여 얻어진 FeO 평균결정립 크기는 약 40 nm이었다. Fig. 2의 XRD 패턴에서도 보여주듯이 볼밀링에 의하여 생성된 Fe3O4와 잔존하는 Fe의 결정립 크기는 FeO상의 그것과 거의 같거나 미세할 것으로 예상된다. 일반적으로 보자력 값은 입자의 크기가 어떤 임계크기 이상에서는 결정립 크기가 감소함에 따라 보자력은 증가하는 다자구 상태로 존재하다가, 임계크기 이하에서는 결정립 크기가 감소함에 따라 보자력이 감소한다.14) 따라서 결정립 크기가 단자구 입자보다 작은 미세구조의 분말에서는 오히려 보자력이 감소하는 초상자성 현상이 나타나는 것으로 설명하고 있다.15,16,17) 8 h 동안 볼밀링한 Fe2O3 ‧ 0.8Fe 분말에서 보자력 값이 감소하는 것은 자성상인 Fe3O4와 잔존하는 Fe 결정립이 단자구 크기 이하로 작아진 것이 그 원인으로 생각된다.16)
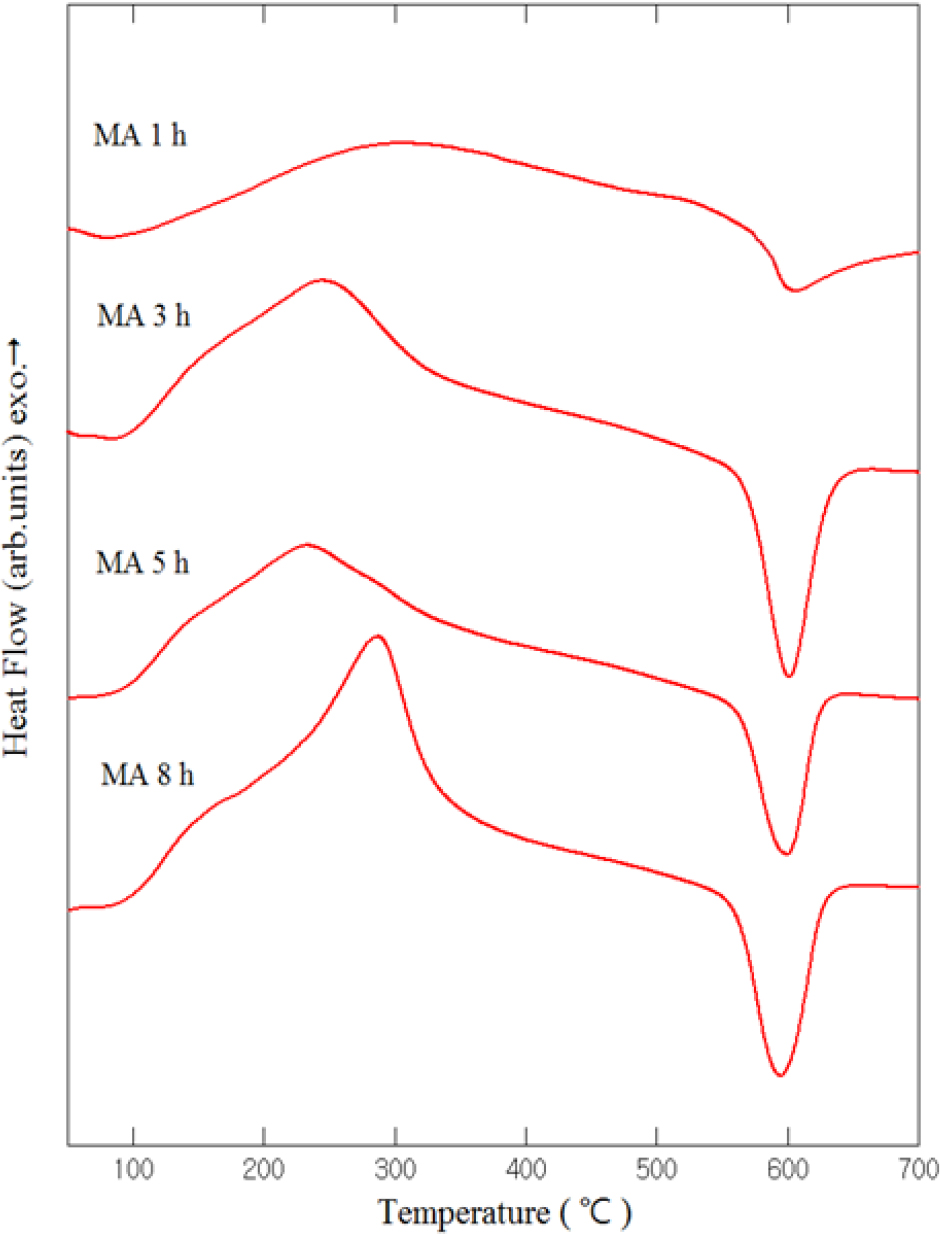
Fig. 6은 각 시간 동안 볼밀링한 Fe2O3 ‧ 0.8Fe 시료에 대하여 700 °C까지 differential scanning calorimetry (DSC) 분석을 실시하여 그 결과를 나타낸 것이다. 모든 볼밀링 시료에서 뚜렷한 발열피크는 관찰되지 않았고, 200~300 °C 근방의 넓은 온도범위에 걸쳐서 발열반응이 일어나며, 600 °C 근방에는 뚜렷한 흡열반응을 보였다.
Fig. 7은 Fe2O3 ‧ 0.8Fe 5 h 동안 볼밀링한 시료에 대하여 열분석 후 결정구조 변화를 알아보기 위하여 500 °C 및 700 °C까지 각각 DSC 분석 후 XRD 패턴을 나타낸 것이다. DSC 분석을 500 °C까지 실시하면 200~300 °C 근방의 넓은 온도범위에 걸쳐 발열반응과 함께 고상반응에 의한 환원이 더욱 진행되어, 출발상 Fe2O3가 모두 소멸되고 Fe3O4이 생성과 함께 Fe 잔존함을 XRD 패턴으로부터 알 수 있다. 이 과정에서 볼밀링에 의하여 축적된 전위, 공공(vacancy), 격자변형 등 결정결함이 완화되며 결정립 성장도 발생하여 XRD 피크의 강도는 강해지고 회절선 폭은 감소하는 것으로 판단된다.11,12) 또한 600 °C 근방의 뚜렷한 흡열반응은 500 °C까지 생성된 중간상 Fe3O4가 700 °C까지 승온 시 FeO로 상변화하며 나타나는 것임을 알 수 있다.
Fig. 8은 DSC 분석을 실시한 Fe2O3 ‧ 0.8Fe 조성의 Fig. 7 시료에 대하여 M-H 곡선을 나타낸 것이다. DSC 분석을 500 °C 및 700 °C까지 했을 때 시료의 Ms 값은 87 emu/g 및 25 emu/g으로 5 h 동안 볼밀링한 시료의 40 emu/g과 차이를 보였다. Ms 값은 분말의 자성상 양에 의존하는 것으로 500 °C까지 승온 열처리시킨 시료에서 최대 값을 보인 것은 Fig. 7 XRD 패턴에서도 알 수 있듯이 Fe2O3 ‧ 0.8Fe계의 고상반응에 의한 환원 과정에서 잔존하는 Fe와 함께 중간 생성상인 자성 Fe3O4 의한 것이라고 판단된다. 따라서 Fe2O3 ‧ 0.8Fe 조성의 시료을 5 h 동안 볼밀링 후 700 °C까지 승온 열처리시키면 환원반응이 더욱 진행되며 거의 단상의 FeO가 생성되나 Fe3O4도 소량 잔존하고 있음을 알 수 있었다.
또한 Fe2O3 ‧ 0.8Fe 조성의 5 h 시료를 500 °C까지 열분석한 경우 Hc 값이 180 Oe 이었는데, 이 값은 5 h 동안 볼밀링한 시료의 340 Oe과 큰 차이를 보였다. 이것은 Fig. 6의 열분석 및 Fig. 7의 XRD 결과에서도 알 수 있듯이 승온에 의하여 볼밀링 과정 중 축적된 전위, 공공(vacancy), 격자변형 등 결정결함의 완화 및 결정립 성장이 발생하는데, 이것에 의하여 보자력 값이 감소하는 자기적 연화(softening) 때문인 것으로 생각된다.16,17)
4. 결 론
성분 원소의 반응열이 정(+)이며 +2.23 kcal/mole로 비교적 작은 값을 가지는 헤마타이트-철계에 대하여 실온에서 볼밀링에 의한 고상반응을 실시하였고, 결정구조, 열분석, 미세조직 및 자기 특성을 통하여 고상 환원반응 거동을 조사하여 다음과 같은 결과를 얻었다.
(1) Fe2O3 ‧ (0.4-1.0)Fe 조성에 대하여 계의 반응열이 +2.23 kcal/mole임에도 불구하고 5 h 동안 볼밀링에 의하여 모두 고상반응에 의한 환원이 진행되어 FeO와 Fe3O4상이 생성됨을 알 수 있었다.
(2) 볼밀링에 의하여 환원반응이 가장 많이 진행된 Fe2O3 ‧ 0.8Fe 조성에 대하여 구조분석, 열분석 및 자기 특성을 자세히 조사하였는데, 5 h 동안 볼밀링한 경우 비교적 균일한 평균입도 약 3 µm의 매우 미세한 복합분말이 얻어졌다.
(3) Fe2O3 ‧ 0.8Fe 조성의 Ms 값은 볼밀링 1 h에 44 emu/g 으로 최대 값을 보인 후 볼밀링 시간에 따라 감소하여 8 h 후에는 23 emu/g로 최소 값을 나타내었다. 한편 Hc 값은 5 h 시료에서 340 Oe로 최대 값을 나타낸 후 8 h 에는 270 Oe로 감소하였다. 이것은 볼밀링 시간에 따라 임계 크기 이하로 자성상의 결정립 크기가 감소함에 따라 보자력이 감소하는 현상에 기인하는 것으로 생각된다.
(4) Fe2O3 ‧ 0.8Fe 조성의 5 h 시료를 열분석한 결과, 200~300 °C 근방에서 완만한 발열반응과 600 °C 근방에 뚜렷한 흡열반응이 관찰되었다. 500 °C까지 열분석한 시료의 경우 승온에 따른 전위, 공공(vacancy), 격자변형 등 결정결함의 완화 및 결정립 성장에 의하여 5 h 동안 볼밀링한 시료에 비하여 낮은 180 Oe의 Hc 값을 보였다.