1. 서 론
방사성 폐기물은 방사성 핵종의 반감기나 붕괴로 인한 방사선 준위에 따라 저준위, 중준위, 고준위 폐기물로 분류하며, 인간과 자연환경으로부터 격리하고, 적절한 형태로 변화시키는 처리 방법은 폐기물의 고형화이며, 관련된 소재 개발과 처리공정에 관한 연구가 진행 중이다.1,2,3,4,5) 반감기가 긴 핵종을 포함하고 많은 붕괴열을 방출하는 고준위 폐기물 처리 방법인 유리고화법은 폐기물의 체적을 줄일 수 있는 간편성 때문에 많은 연구가 되었다.6,7,8,9,10,11) 유리고화체(붕규산유리)의 경우는 물이나 고온의 증기에 의해서 실투화 또는 상분리 현상이 발생할 수 있기 때문에 유리의 표면적 증가로 인한 미세균열 발생으로 내부에 고착된 방사성 핵종의 외부로의 용출이 증가하는 단점이 있다.12,13,14) 이런 단점을 해결하기 위해 안정한 세라믹스가 연구되고 있으며, 대표적인 것이 SYNROC (synthetic rock, 합성암)이다.15,16)
SYNROC은 자연상태의 안정한 광물인 hollandite, perovskite 및 zirconolite의 결정격자 내에 고용체의 형태로 방사성 원소를 장기간 고정할 수 있고, 지질학적 안정성이 우수한 인위적으로 합성한 광물이다.15,16,17,18,19) Hollandite는 알칼리 및 알칼리 토류 원소를 결정격자 내에 고정할 수 있는 기능을 가진 결정상이며, 광범위한 조성[Ax(Ti4+,B)8O16, (A = Ba2+, Cs+, Sr2+; B = Al3+, Fe3+, Mg2+, Ti3+)]으로 방사성 핵종 중에 주로 Sr과 Cs이 Ba과 2~5 wt% 정도 치환이 가능하다. Hollandite는 이온치환능력과 방사성 핵종의 용출에 대한 저항성이 비교적 크기 때문에 SYNROC의 주요 구성 요소광물이다.
방사성폐기물을 고화 처리하는 공정은 간편하고 간단한 공정으로 안전하고 신속하게 작업 되어야 한다. 또한 공정 중에 방사능 물질의 발생과 유출을 최소화 하는 공정으로 진행되어야 한다. 고준위 방사성 폐기물 고화처리 공정 중에서 고상반응법과 유리화공정은 이러한 작업의 간편성과 복잡성을 줄이는 공정방법이다. SYNROC의 경우도 주로 산화물 혼합 소결공정(고상반응법)으로 결정질로 합성하지만, 고온의 반응온도와 장시간의 열처리공정이 필요하고, 확산반응을 통한 여러 단계의 고상 합성이 일어나기 때문에 결정상의 불균질성과 입계에 미반응상이 존재하는 단점이 있다. 연소합성법은 수용액 중에서 금속 질산염과 연료의 산화, 환원 반응에서 발생하는 반응열을 통해 자기 발화되는 반응으로, 자체 연소에 의한 열을 이용하여 연속반응을 유지시키고, 비교적 저온에서 최종 생성물을 합성하는 방법이다. 액상에서 분자간의 혼합반응으로 생성분말의 균질성이 좋고, 합성 시 발생하는 많은 양의 가스에 의해 분말이 미세하고, 반응시간이 비교적 짧으며, 저온에서도 결정질의 분말이 얻어지므로 별도의 하소공정 없이 결정질의 분말을 얻을 수 있는 장점이 있다. 미세조직이 미세하고 균일하여 합성 후 미반응물이 적게 형성되고, 폐기물원소의 외부로의 내용출측성이 우수하게 되어, 다량의 폐기물원소를 고형화하는 장점이 있다.20,21,22,23,24,25,26,27) 산업적으로 가능한 고준위폐기물 습식처리방법은 방사성원소를 산으로 용해한 금속질산염을 연소합성법의 출발물질로 사용할 수 있다.
본 연구에서는 연소합성 반응에서 연료와 금속질산염과의 결합 및 연소반응 특성에 연료가 미치는 영향을 알아보았으며, SYNROC 광물 중에서 핵종 이온치환능력과 방사성 핵종의 용출에 대한 저항성이 높은 hollandite 분말을 연소합성법으로 합성하여 산화물 합성법으로 제조된 hollandite 분말과 특성을 비교하였다.
2. 실험 방법
산화물 혼합공정은 hollandite 조성의 출발물질을 혼합하여 습식 볼밀링하고, 12 h 동안 상온에서 건조시켜, 900 °C에서 1 h 동안 소성하였다. 연소합성공정은 Ba(NO3)2 (Sigma-Aldrich, 99 %), Al(NO3)3 ‧ 9H2O (Sigma-Aldrich, 98 %), Sr(NO3)2 (Sigma-Aldrich, 99 %) 질산염과 TiO(NO3)2 xH2O는 5 M의 농도가 되도록 수용액으로 자체 합성하여 사용하였다. 연소반응에 첨가되는 연료로는 아민기와 카르복실기를 동시에 갖는 glycine, 아민기만 갖는 urea, 카르복실기만 갖는 citric acid와 citric acid와 urea의 혼합연료를 사용하였으며, 산화와 환원이 균형을 이루도록 산화제와 연료간의 원자가 비율을 통해 연료의 양을 계산하여, elemental stoichiometric coefficient (ψe)값을 반응에 필요한 전자와 공급되는 전자의 비를 통해 첨가되는 연료량을 계산하였다.28) 화학양론적인 조성일 경우 ψe = 1이며, ψe < 1이면 연료가 부족하고, ψe > 1이면 과량의 연료가 반응된 것이다. 연소반응은 금속질산염과 연료의 산화환원 반응의 높은 반응열에 의해 일어나고, 알칼리와 알칼리 토금속은 카르복실기에 의해 산화되고, 전이금속과 알루미늄은 아민기에 의해 환원된다. 연료의 작용기에 의해 연소반응이 좌우되므로, 금속질산염과 연료의 화학양론적 비율이 1:1인 조건에서 합성된 분말의 특성이 우수하다. 연료의 작용기와 어떤 금속원소가 연료와 결합되어 반응하는지 확인하기 위해 FT-IR (Fourier transform infra-red) (FT/IR-4200, JASCO, Japan) 분석을 하였다. TG (thermogravimetric analysis)-DTA (differential thermal analysis) (Setaram, Switzerland)를 통해 연료의 종류에 따른 연소 반응의 반응열 차이를 확인하였다. 다양한 연료 조건으로 합성된 분말 특성을 확인하기 위해 XRD (X-ray diffraction)를 통해 결정상을 확인하고, SEM (scanning electron microscope)/EDS (energy dispersive spectrometer)을 통해 분말의 미세조직과 조성 균일성을 확인하였다. 고상반응법과 연소합성법의 전체 실험도는 Fig. 1에 나타내었다.
3. 결과 및 고찰
연소합성법은 금속질산염과 연료의 산화환원 반응에서 발생하는 반응열로 진행된다. 알칼리와 알칼리 토금속은 카르복실기와 결합하여 산화되고, 전이금속과 알루미늄은 아민기와 결합하여 의해 환원된다. 이러한 반응메커니즘을 확인하기 위해 연료의 적외선 스펙트럼 결과와 작용기의 스펙트럼을 비교하여 연료의 분자구조를 확인하고, 그 연료와 hollandite 각 구성원소를 포함한 금속질산염의 전구체의 스펙트럼의 결과를 비교하여, 어떤 원소가 어느 작용기와 반응하는지 확인하였다. Glycine은 작용기로 NH2인 아민기와 COOH인 카르복실기를 1:1의 비율로 갖는 연료이다. 물에 용해되어 NH3+CH2COO-의 양쪽성 이온 형태로 존재한다.16) Glycine은 1,616 cm-1에 비대칭[νas(COO-)], 1,409 cm-1에 대칭[νs(COO-)]의 존재를 통해 carbonyl band가 존재한다는 것을 알 수 있다. 3,423, 3,173, 2,920 cm-1는 보통 OH stretch의 위치이지만, 양쪽성 이온인 glycine은 OH group을 가지고 있지 않으므로 NH group으로 해석할 수 있다.
Fig. 2는 hollandite 구성원소 및 첨가이온 질산염(Ba, Al, Ti and Sr)과 glycine과 반응 후 전구체 분말의 FT-IR 분석결과이다. Fig. 2(a)는 glycine의 FT-IR 결과이며, Fig. 2(b, c)는 Ba와 Sr의 결과이다. 1,409 cm-1에 대칭[νs(COO-)] carbonyl 결합을 나타내는 피크가 눈에 띄게 감소한 것을 확인할 수 있다. 알칼리, 알칼리 토금속인 Ba, Sr은 carboxyl groups과 반응하여 C=O 이중결합이 영향을 주게 되어 대칭[νs(COO-)]이 약화된 것으로 볼 수 있다. Fig. 2(d, e)의 glycine과 Al, Ti 전구체의 FT-IR 결과를 보면 NH groups에 해당하는 3,423, 3,173, 2,920 cm-1의 위치와 absorbance에는 큰 변화가 없는 것으로 관측되지만, Al, Ti는 1,745 cm-1에 새로운 absorbance가 나타난 것을 확인할 수 있다. 이는 보통 산에서 carbonyl band의 평균 carboxyl 이중결합(νC=O)이 위치에 해당한다. Al과 Ti 전이금속이 glycine의 아민기와 반응하여 양쪽성 이온으로써의 성질을 잃어 보통 산이 C=O 이중결합을 나타내는 위치에 새로운 C=O 이중결합 피크가 관측되는 것으로 보인다.
Fig. 3(a)는 glycine을 연료로 사용한 hollandite 전구체의 TG-DTA 분석 결과이다. 155 °C에서 나타나는 약한 흡열 피크는 전구체의 탈수를 의미한다. 210~220 °C의 범위에서 산화환원 반응과 연소에 의한 높은 발열 피크를 갖는 전구체의 분해 과정을 보여준다. 전구체는 처음 중량의 약 78.3 wt%의 질량감소를 보인다. 상온에서 200 °C까지의 질량감소는 17 wt%이고, 이는 전구체에 물리적으로 흡착된 물의 탈착으로 인한 것으로 사료된다. 질량 감소가 많이 분석되는 200~250 °C 구간은 누적질량감소량이 약 64 wt%이고, heat flow의 최대값을 포함한다. 뚜렷한 질량 감소와 높은 발열량을 통해 금속질산염과 glycine의 자발 착화를 통한 분해를 알 수 있다. 300 °C 이상의 온도에서 질량변화는 거의 없고, 600 °C까지의 총 질량감소량은 79 wt%이다. Fig. 3(b)는 urea를 연료로 하는 hollandite 전구체의 TG-DTA 분석 결과이다. 총 누적질량감소량 약 78 wt%로 glycine과 비슷하지만, 물의 증발로 인한 질량감소인 상온에서 200 °C까지 구간에서 약 8 wt%로 glycine보다 훨씬 작은 질량감소를 보인다. 200~250 °C 사이에서 급격한 질량 감소와 높은 발열 피크를 보였던 glycine과는 달리 urea는 200~300 °C의 넓은 온도 범위에서 비교적 완만한 질량감소를 보인다. 누적 질량감소량은 약 74 wt%로 총 질량감소량인 78 wt%와 크게 차이 나지 않는다. 상온과 200 °C 사이에서 물이 증발되는데 필요한 잠열로 추측되는 흡열피크가 확인되는 점은 glycine 연료와 비슷하지만, 큰 발열반응으로 반응이 완료되었던 glycine과는 달리, 2회에 걸쳐 발열 피크가 관측된다. 질량감소가 시작되는 240 °C와 질량감소가 끝나가는 290 °C에서 두 번째 발열 피크가 관측된다. 이를 통해 연료로 urea를 이용한 반응은 glycine을 이용한 반응보다 반응시간이 길며, 자기 착화반응이 일어나는 온도가 낮고, 반응에 수반되는 반응열도 낮다는 것을 확인할 수 있다.
연소합성법에서 연료의 양과 종류에 따른 hollandite (BaAl2Ti6O16)의 분말의 변화를 확인하기 위해서, 연료로 glycine, urea 및 citric acid와 citric acid/urea 혼합연료의 혼합비가 다른 조건에서 합성하였다. 금속질산염의 조성은 BaAl2Ti6O16의 조성을 갖도록 고정하고, 금속질산염과 연료의 비인 elemental stoichiometric coefficient, φe의 값이 1에서 4 사이인 조건으로 실험을 진행하였다. 연료의 양과 종류에 따른 연소거동을 Table 1에 나타내었다. Glycine을 사용한 연소합성법에서 φ가 1G의 양에서는 반응이 일어나지 않았다. 2~4G에서는 약한 연소반응이 관찰되었다. 합성된 분말의 잔류 유기물 성분과 carbon을 제거한 분말의 XRD 패턴을 Fig. 4(a)에 나타내었다. Hollandite 결정이 모든 연료 조합에서 분석되었으며, rutile이나 다른 결정상 분석되지 않았다. Glycine 연료의 양이 많아질수록 피크 폭이 좁고 강도가 강해지는 경향을 보인다. 연료의 양이 많을수록 산화환원에 의한 발열량이 많아지고, 방출된 열은 결정의 성장을 촉진하여 결정 크기의 성장을 돕는 것으로 알려져 있다.15)
Table 1.
Effect of fuel types and amount of fuel compositions on the synthesis of hollandite (BaAl2Ti6O16).
Urea를 연료로 사용한 경우는 φ가 증가하여도 연소 반응이 일어나지 않고, glycine에 비해 많은 가스가 생성되며, 불투명하고 끈적한 겔 형태의 전구체가 형성되었다. Fig. 4(b)는 urea를 이용하여 연소합성한 분말은 hollandite 결정과 rutile 결정 피크를 보여준다. 연료의 사용량이 증가할수록 rutile은 점점 줄어들고 3U에서는 rutile은 분석되지 않았다. Urea 연료량이 많을수록 불순물이 적은 최종생산물을 얻을 수 있다는 것을 알 수 있다. 또한, urea의 φ이 증가할수록 hollandite 첫 번째 피크의 면간 거리가 증가하고, 강도는 약해진다. 이는 glycine의 φ이 증가할수록 hollandite 결정피크가 좁고, 강한 강도를 띄는 것과는 반대의 양상을 보이며, 연소 과정 중 방출된 기체 생산량 때문이다. 연소의 열과 방출된 가스의 몰수는 보편적으로 φ가 증가할수록 증가한다.23,24,25) 연소 과정의 발열량이 높을수록 결정의 성장을 촉진하지만, 연소 과정에서 방출된 기체 생산물은 이 발열량이 빨리 발산시켜 결정크기의 성장을 방해한다. Urea를 연료로 사용하는 경우, 연소 과정의 발열량보다 기체 생산물에 의해 발산되는 열이 많아 연료의 양이 증가할수록 결정 크기가 작아지는 양상을 보이는 것이다. Fig. 4(c)는 연료로 citric acid만 단독으로 사용한 경우, urea를 단독으로 사용한 경우와 마찬가지로 3φ에서도 연소반응이 일어나지 않았다. 반응 중 urea보다 더 많은 기체가 방출되었으며, 연료량과 관계없이 순수한 hollandite 결정 피크는 형성되지 않았으며 anatase, rutile 및 hollandite과 확인할 수 없는 결정상이 분석되었다. Fig. 4(d)는 citric acid와 urea를 다양한 비로 혼합하여 연소합성한 분말의 XRD 결과이다. 1CA-1U와 1CA-2U 조건에서는 약한 연소반응이 일어났으며, rutile과 hollandite 및 barium titanate 결정피크가 함께 관찰되었다. Barium titanate 결정은 citric acid의 양이 많아질수록 더 강한 강도를 보였다. 연료의 작용기가 아민기 또는 카르복실기만으로 이루어진 urea와 citric acid를 연료로 각각 사용한 경우는 각 작용기에 반응을 하지 않은 원소들이 있으므로, 불완전한 산화 환원반응으로 분말합성이 이루어지지 않은 것으로 사료된다. 다양한 연료와 연료의 양을 다르게 한 조건에서 합성한 분말의 XRD 패턴을 통해서 연료의 종류와 양이 연소합성법으로 합성된 최종생성물의 결정에 많은 영향을 미치는 것을 확인할 수 있었다. 이 중에서 hollandite 결정피크만 관찰된 것은 2G, 3G, 4G 그리고 1CA-2U의 네 가지 연료 조건에서였다. 따라서 연소합성법으로 hollandite를 제조하는데 최적의 조건은, 작은 양의 연료를 사용하면서 hollandite 결정 피크 외에 다른 결정 피크가 관찰되지 않은 2배의 glycine연료(2G)로 합성하는 경우이다.
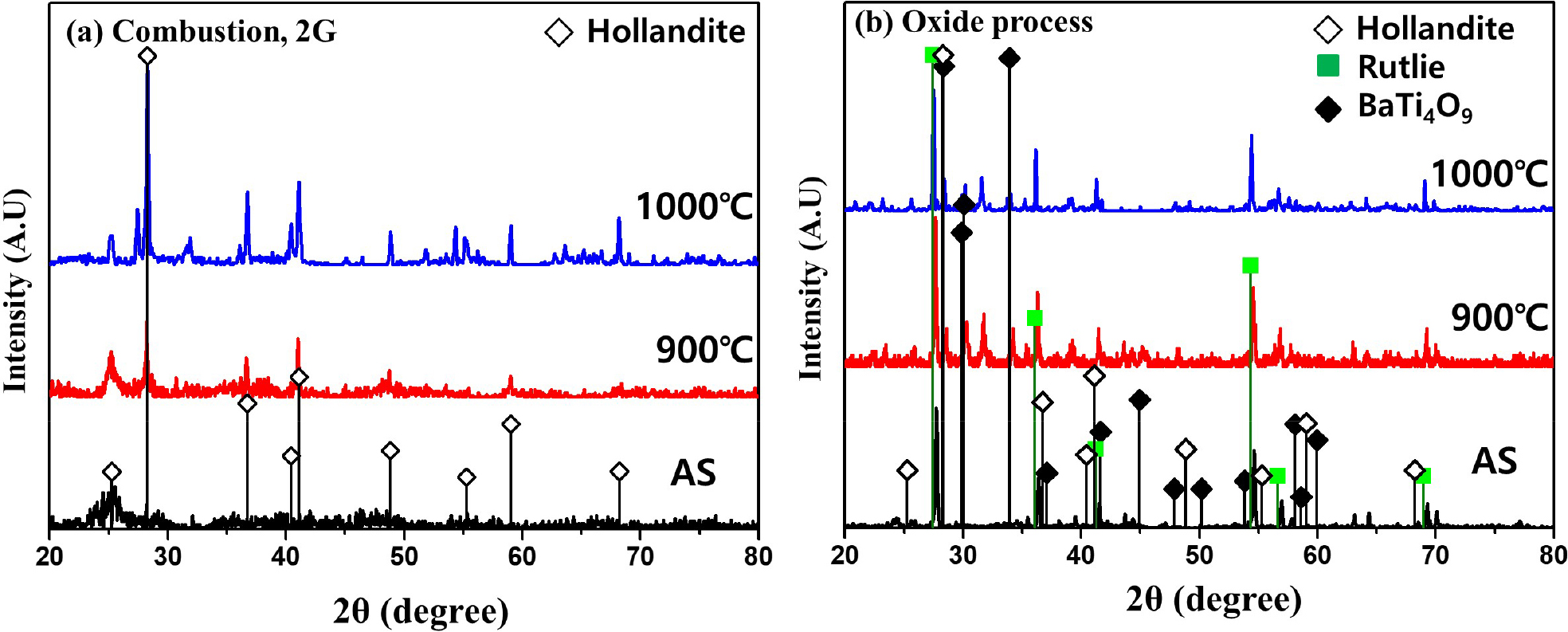
최적 조건인 2φ glycine을 사용하여 연소합성법으로 제조된 hollandite와 산화물 혼합법으로 제조된 hollandite 분말의 XRD 패턴을 소성온도별로 비교하였다. Fig. 5(a) 1,000 °C의 소성온도에서는 hollandite 결정피크의 강도가 더 강하고, 면간거리가 더 좁게 관찰된다. 이를 통해 소성온도의 증가로 hollandite 결정 크기가 성장하였음을 확인할 수 있다. 반면에, Fig. 5(b)의 산화물 혼합법으로 제조된 분말은 소성온도를 1,000 °C까지 높여도 hollandite 결정피크 외에 rutlie과 BaTi4O9의 결정상과 식별하기 어려운 결정피크가 함께 관찰된다. 산화물 혼합법으로 제조된 분말은 소성온도를 높여도 hollandite 결정 외에 다른 의도하지 않은 결정이 많이 관측된다. 이를 통해 산화물 혼합법은 연소합성법과 달리 반응이 단계적으로 진행되며, 그 과정에서 rutlie과 같이 반응하지 않은 미반응물과 의도하지 않은 많은 중간물들이 생성되기 때문이다. 이러한 결과를 통해 연소합성법으로 제조된 hollandite 분말 내 구성원소들이 더 균질하게 분포되어 있고, hollandite의 결정입자 외에 다른 결정이 관찰되지 않는 것을 알 수 있다.
Fig. 6은 주요 방사성 핵종인 Sr을 5 wt% 고용한 hollandite 분말을 고상반응법과 연소합성법으로 합성한 분말의 주사전자현미경 미세조직과 EDS maping 분석결과이다. 현미경사진을 보면 연소합성분말은 30 nm 이하의 미세한 분말이 균일한 크기로 형성되어 있으며, 고상반응분말은 미반응한 분말과 불균일한 형태로 응집체를 형성함을 알 수 있다. EDS maping 결과를 보면, 고상반응법으로 합성된 분말은 hollandite 결정 외에 미반응 알루미나 분말이 응집되고 불균일하게 분포된 형상을 볼 수 있으며, 첨가된 방사성 원소인 Sr이 불균일하게 고용되어 있음을 알 수 있다. Sr이 균일한 고용이 되지 않는다면, 결정입계에 존재하는 Sr이 지중 처분된 후에 지하수에 용출이 쉽게 되는 치명적인 결과를 초래하게 된다. 그러나 연소합성된 분말의 경우는 미세하고 형상이 균일하며, hollandite 구성원소인 Al, Ba, Ti의 분포가 균일하고, 고용된 Sr 원소가 매우 균일하게 고용되어 있음을 알 수 있다. Hollandite 결정에 고용되는 Sr과 같은 방사성원소는 결정조직 내에 균일하게 고용되어야 지중처분에 대한 건정성을 보장할 수 있으므로, 연소합성공정이 고준위 방사성 폐기물을 균일하게 고용하는 적정한 고화공정임을 알 수 있다.
4. 결 론
연소반응에서 연료와 금속질산염과의 반응 및 첨가연료가 미치는 영향을 알아보았으며, hollandite 분말 및 주요 폐기물 방사성원소인 Sr을 첨가한 분말을 합성하여 분말 특성을 고찰하고, 일반적인 산화물 합성법과 비교하여 분말제조법에 따른 특성을 비교하였다
(1) 연소반응은 연료의 작용기와 금속질산염의 산화환원 반응에서 발산되는 강한 반응열에 의해 진행된다. 연료는 보통 아민기와 카르복실기의 두 가지 작용기 중 하나 또는 둘 모두를 갖고 있다. 금속 질산염의 금속원소가 알칼리, 알칼리 토금속이라면 카르복실기와 반응하고, 전이원소이면 아민기와 반응하는 것을 FT-IR 분석을 통해 확인할 수 있었다.
(2) Glycine을 연료로 사용한 경우 200~250 °C의 좁은 온도 범위에서 강한 발열반응을 나타내며 이 반응으로 대부분의 무게감소가 일어난다. Urea를 연료로 사용한 경우 200~300 °C의 넓은 온도 범위에서 glycine에 비해 비교적 약한 발열반응이 나타나며, 대부분의 무게감소는 첫 번째 발열반응에서 관찰된다.
(3) 첨가된 연료의 종류와 양 및 혼합조성에 따라서 합성된 분말의 특성이 다르게 나타났다. 화학양론적 양보다 과량첨가한 glycine과 citric acid와 urea의 화학양론적 비를 1:2로 사용한 혼합연료를 연료로 사용한 경우에 연소합성을 통하여 hollandite (BaAl2Ti6O16) 단일상이 형성되었다.
(4) 연소합성법을 통해 hollandite 분말을 합성하는 최적의 반응조건은 화학양론적 양의 2배의 glycine을 연료로 사용하는 것이다. 합성된 분말의 구성원소와 폐기물원소가 균일하게 분포되어 있어 지중처분 시 외부로의 유출을 억제할 수 있는 미세조직을 형성하였다. 연료와 금속질산염으로부터 직접 합성되는 연소합성법이 방사성 폐기물 고화체 합성에 적절한 공정임을 알 수 있다.