1. 서 론
저마나이트(germanate)는 주기율표상 14족에 속하는 화학 원소들로 탄소족(carbon group)원소라고도 한다. 저마나이트를 기반으로 유리 네트워크가 형성된 중금속 산화물 유리(heavy metal oxide, HMO)는 실리카보다 포논 에너지가 높으며, 중적외선 투명도가 높다는 특징이 있으며, 우수한 기계적, 열적, 화학적 안정성을 바탕으로 중적외선 파장에서 플루오라이드 및 칼코게나이드계 유리보다 안정적이다.1,2,3) 중적외선 영역은 1,000 °C 이하인 복사체의 복사 파장 영역에 해당되는데, 이를 활용하여 열분포 영상을 얻는 열화상 기술에 응용되고 있다. 중적외선 열화상 기술은 연구개발 분야, 예방 유지보수 분야, 보안 및 화재 감시 분야, 의료 및 채혈진단 분야 등에 널리 이용되고 있다.4) 최근 몇 년 동안 소형 포맷(160 × 120 pixel array) 및 비정질 실리콘 마이크로볼로미터(micro bolometer)의 개발로 검출기 비용이 크게 감소하였지만, 열상 카메라의 또 다른 중요한 광학적 구성 요소(렌즈)는 변화하지 않았다.
적외선 영상장비용 광학렌즈로 사용되는 소재로는 germanium (Ge), silicon (Si), zinc sulfide (ZnS), zinc selenide (ZnSe), sapphire (Al2O3) 등 결정 소재가 주로 사용되고 있으며,5) 이 중 단결정 germanium 소재의 굴절률은 4.0 이상으로 높은 굴절능을 통해 대구경으로 사용될 수 있다. 이는 수차를 줄이는데 큰 도움이 되어 널리 사용되고 있지만 Ge의 경우 기본적으로 시장가격이 높게 형성되어 있고, 유동성이 크다는 단점이 있다. 또한 단결정으로 성장시켰을 시 결함(defect)으로 인한 실제 가용면적은 60 % 정도의 낮은 수율로 생산되고 있어 대량화를 이루기에 어려움이 존재한다. 단결정 Ge의 경우, 열화상 카메라에 장착되기 위해서 비구면 렌즈로 가공을 실시해야 하는데, DTM (diamond turning machining) 가공공정을 통해서만 제작할 수 있다. DTM 가공의 경우, 형상가공 정밀도가 매우 높다는 장점을 가지고 있으나, 반면 높은 가공 정밀성으로 인하여 가공속도가 느려 생산성이 떨어진다.6) 이러한 단점을 보완하기 위해 최근 저마나이트 중적외선 렌즈 제작 공정은 양산성이 우수한 GMP (glass molding press)를 통한 제작에 관심을 두고 있다. 기존의 결정소재 적외선 렌즈를 대체하기 위하여 상대적으로 경제적으로 유리하고, 공정방법이 단순하며, 몰드성형용 방식에 적합한 소재인 저마나이트계 유리에 대한 관심이 증가하고 있다. 최근 문헌에서는 몰드 성형법을 통한 적외선 렌즈 제작 시 열팽창, 응력 등에 의해 발생되는 성형오차 및 형상오차에 대한 연구 등이 활발하지만 정작 그 원소재 개발에 대한 연구는 상대적으로 부족한 실정이다.7)
중적외선 광학유리용 산화물계는 calcium aliminate계, tellurite계, heavy metal oxide계, fused silica, germanate계 등으로 구분된다. 이 중 heavy metal oxide계는 PbO-Ga2O3-Bi2O3계와 Ga2O3 일부를 치환한 PbO-Ga2-xO3-GexO2-Bi2O3계 등이 연구된다. 이들의 굴절률은 2 이상으로 높고, 유리전이온도는 400 °C 이하로 낮으며, wavelength cut-off는 7 µm 부근으로 중적외선용 광학 유리로 적합한 부분도 있다. 하지만 경도가 낮으며, 유리전이온도와 결정화 온도의 차이가 좁아 쉽게 결정화되는 단점이 있다. Gemante계 역시도 다양한 조성이 연구되고 있으며, 그 중 대표적으로 BaO-GeO2-Ga2O3계를 주 성분으로, CaO, BaO, SrO를 일부 치환한 유리 조성 계이다. 이는 BGG Glass로 알려진 BaO-Ga2O3-GeO계, 최근 suimta glass에서 특허 낸 GeO2-MO-MF (M = K, Na, Mg, Li, Sr, Ba, Ca, Al, Y, Zn, Gd, La 중 하나 이상)계 등이 있다. 이들은 가시광 영역에서 중적외선 영역까지 투과성능이 우수하며, 강도와 내후성 또한 양호한 것으로 알려져 있다.
본 연구에서는 BaO-GeO-La2O3-ZnO계 저마나이트 산화물유리의 전이온도, 열팽창계수, 경도 등 적외선 렌즈의 물리적 특성변화 및 유리의 안정화를 위하여 Sb2O3를 첨가하였다. Sb2O3 함량에 따른 구조적, 열적, 광학적 분석을 통하여 중금속 산화물 유리의 특성을 평가하였고 그에 따른 확산거동을 관측하였다. 이를 통하여 렌즈로 사용이 가능한 유리 안정성을 평가하여 GMP 공정을 통하여 제조 사용될 수 있는 저마나이트 산화물유리의 최적 조성을 도출하였다.
2. 실험 방법
16BaO-56GeO2-38La2O3-(20-x)ZnO-(x)Sb2O3 유리 제조를 위하여 시료는 3 N 이상의 BaCO3 (99.9 %, Kojundo Chemical Laboratory Co., Ltd., Japan), GeO2 (99.9 %, Kojundo Chemical Laboratory Co., Ltd., Japan), La2O3 (99.9 %, Kojundo Chemical Laboratory Co., Ltd., Japan), ZnO (99.9 % Kojundo Chemical Laboratory Co., Ltd., Japan), Sb2O3 (99.9 % Kojundo Chemical Laboratory Co., Ltd., Japan)를 사용하였다. Table 1에 5가지 샘플의 조성비를 나타내었으며, BaO와 GeO2를 각각 16 mol%와 56 mol%, La2O3를 8 mol%를 기본조성으로 ZnO와 Sb2O3의 첨가량을 조절하였다.
Table 1.
Composition change according to ZnO and Sb2O3 content of 16BaO-56GeO2-38La2O3-(20-x)ZnO-(x)Sb2O3 system glass.
| Component | BaO | GeO2 | La2O3 | ZnO | Sb2O3 | |
| Content (molar ratio) | No. 1 | 16 | 56 | 8 | 20 | 0 |
| No. 2 | 16 | 56 | 8 | 19 | 1 | |
| No. 3 | 16 | 56 | 8 | 18 | 2 | |
| No. 4 | 16 | 56 | 8 | 17 | 3 | |
| No. 5 | 16 | 56 | 8 | 16 | 4 | |
중금속 산화물계 유리 제작은 ribbon cullet를 이용한 용융-냉각 방법을 통해 제작되었는데, 용융유리의 높은 온도로 인한 금속 오염을 줄이기 위하여 텅스텐합금 재질의 roller를 사용하였으며, 이온교환에 의한 오염을 줄이기 위하여 순도 99.99 % 백금도가니를 사용하였다. 원재료를 조성에 따라 칭량한 후 중금속 산화물 유리의 용융을 진행하였다. 용융 조건은 시료의 녹는점을 고려하여 전기로(furnace)에서 1,400 °C에서 2시간 20분간 용융 후 온도를 조금 내려 끓는점 안정화, 액체상태의 안정화를 위해 1,300 °C에서 다시 2시간 20분을 유지하여 2차 용융하였다. 이후 맥리현상 발생을 억제하고자 1,300 °C에서 중금속 산화물계 유리의 균질화를 위하여 1시간을 더 유지하였다. 이와 같은 용융조건은 Sb의 끓는점이 Ge의 녹는점보다 낮아 Ge와 Sb가 혼합되지 않고 Sb가 기화되는 것을 막고 Zn, Ba, La와의 균일한 혼합을 위함이며, 용융 도중 조성 간의 혼합이 잘 이루어지도록 1,300 °C에서 일정시간 동안 유지시켜 충분한 대류가 일어나도록 하였다. 이 후 용융된 시료는 대기 중에서 약 5초간 냉각 후 흑연몰드에 성형하여 소둔(annealing) 과정을 통하여 비정질 상태의 중금속 산화물계 유리 벌크를 제조하였다.
제조된 중금속 산화물 유리의 조성별 상변화 및 결정상을 알아보기 위하여 X선 분석장치[X-ray diffractometer (XRD), SmartLab, RIGAKU, Japan]를 사용하였으며 Cu-Kα 특성파장을 이용하여 scan speed 4/min의 속도로 분석을 실시하였다. 또한 형광 X선 분석장치[X-ray fluorescence analyzer (XRF), XGT-5000, HORIBA, Japan]를 사용하여 제조된 16BaO-56GeO2-38La2O3-(20-x)ZnO-(x)Sb2O3계 유리의 정량적인 조성변화를 확인하였다. 또한 16BaO-56GeO2-38La2O3-(20-x)ZnO-(x)Sb2O3계 유리의 유리전이온도 및 결정화온도 등의 열적 특성확인을 위해 용융-냉각법을 통해 제조된 중금속 산화물 유리를 막자사발을 사용하여 분말형태로 제조한 후, 분말형태의 중금속 산화물 유리를 열분석기[differential thermal analysis (DTA), DTG-60H, SHIMADZU, Japan]를 사용하여 질소분위기하에서 Al seal을 사용하여 20 °C/min 조건으로 상온~1,000 °C 온도 범위로 측정하였다. 16BaO-56GeO2-38La2O3-(20-x)ZnO-(x)Sb2O3계 유리의 투과율 및 굴절율은 각각 분광광도계(Spectrophotometer, U-3900, HITACHI, Japan)와 Abbe 굴절계(Abbe Refractometer, NAR-2T, ATAGO, Japan)를 사용하여 측정하였다. 제조된 중금속 산화물계 유리를 diamond saw를 이용하여 평면상태로 1차 가공하였으며, 이후 polishing machine을 통하여 표면을 2차 가공 후 측정하였다. 조성변화에 따른 시료 각각의 경도확인을 위해 비커스경도기(Vickers Hardness, HM-101, AKASHI, Japan)을 사용하였다. 각각의 시료는 polishing machine을 사용하여 #600에서 #8000까지 연마 후 1 N 하중으로 3회 측정 후 평균값으로 나타내었다.
3. 결과 및 고찰
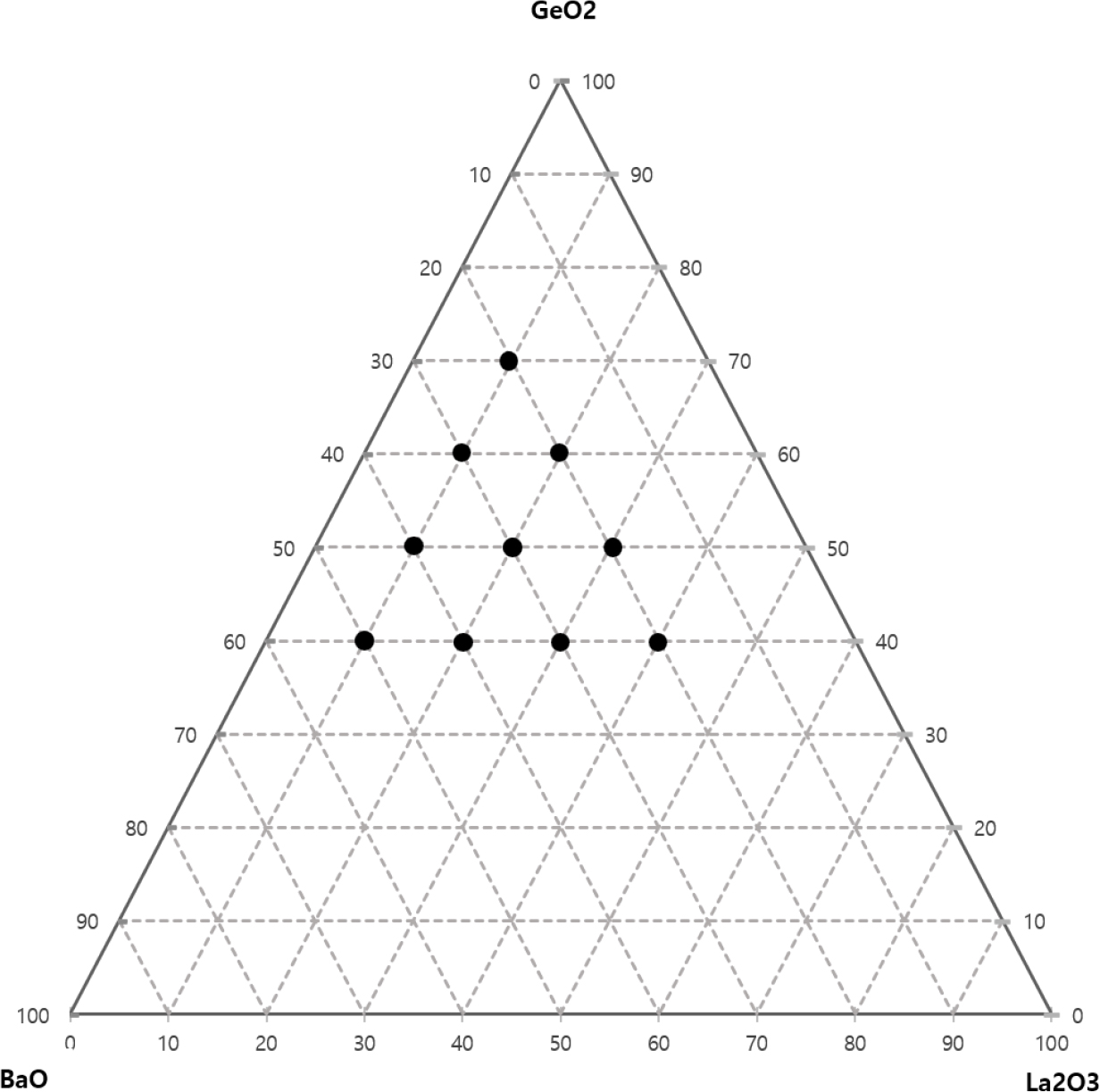
BaO-GeO2-La2O3를 주성분으로 하는 유리제조 및 유리의 조성비 결정을 위해 Fig. 1의 BaO-GeO2-La2O3계 상평형도를 활용하였다. 삼성분계 상태도 위에 나타낸 검은색 점이 유리화가 가능한 범위로 이전연구에 따르면 각각 Ge 함량이 70 % 이상, La 함량이 40 % 이상, Ba 함량이 50 % 이상의 경우 결정화 가능성이 증가하는 것으로 알려져 있다.8,9,10)
또한, xBaO-(72-x)GeO2-8La2O3-20ZnO 유리형성 시스템에서 BaO 첨가량이 증가함에 따라 유리전이온도가 증가하였으며, CTE 값도 BaO 첨가량이 증가함에 따라 증가하는 것으로 알려져 있으며, 그 중 GeO는 SiO2에 비하여 용융 온도가 낮고 유리전이온도가 낮고 굴절률이 높다는 점에서 이점이 있다.11) 반면 Ge 함량이 증가할수록 유리전이온도, 결정화 온도가 증가하며, 밀도와 열팽창계수를 감소시키고, 돌(stone), 기포(bubble), 맥리(striae) 등을 발생시키게 된다. 또한 몰드 성형 시 금형코어 및 소재에 발생하는 열적 stress를 감소시키기 위하여 낮은 성형온도를 유지해야 하는데, 이 때 소재의 유리전이온도와 연화온도가 성형온도를 결정하는 인자로 작용한다. 이를 고려하여 유리화가 가능한 범위 내에서 BaO-GeO2-La2O3의 조성을 결정하였으며, 유리전이온도와 연화온도를 낮추기 위한 목적으로 ZnO를 첨가하였고, 유리전이온도(Tg), 경도, 굴절률, 내부응력, 맥리 등에 대한 구조적 안정화를 위하여 Sb2O3의 첨가량을 조절하여 특성을 평가하였다.
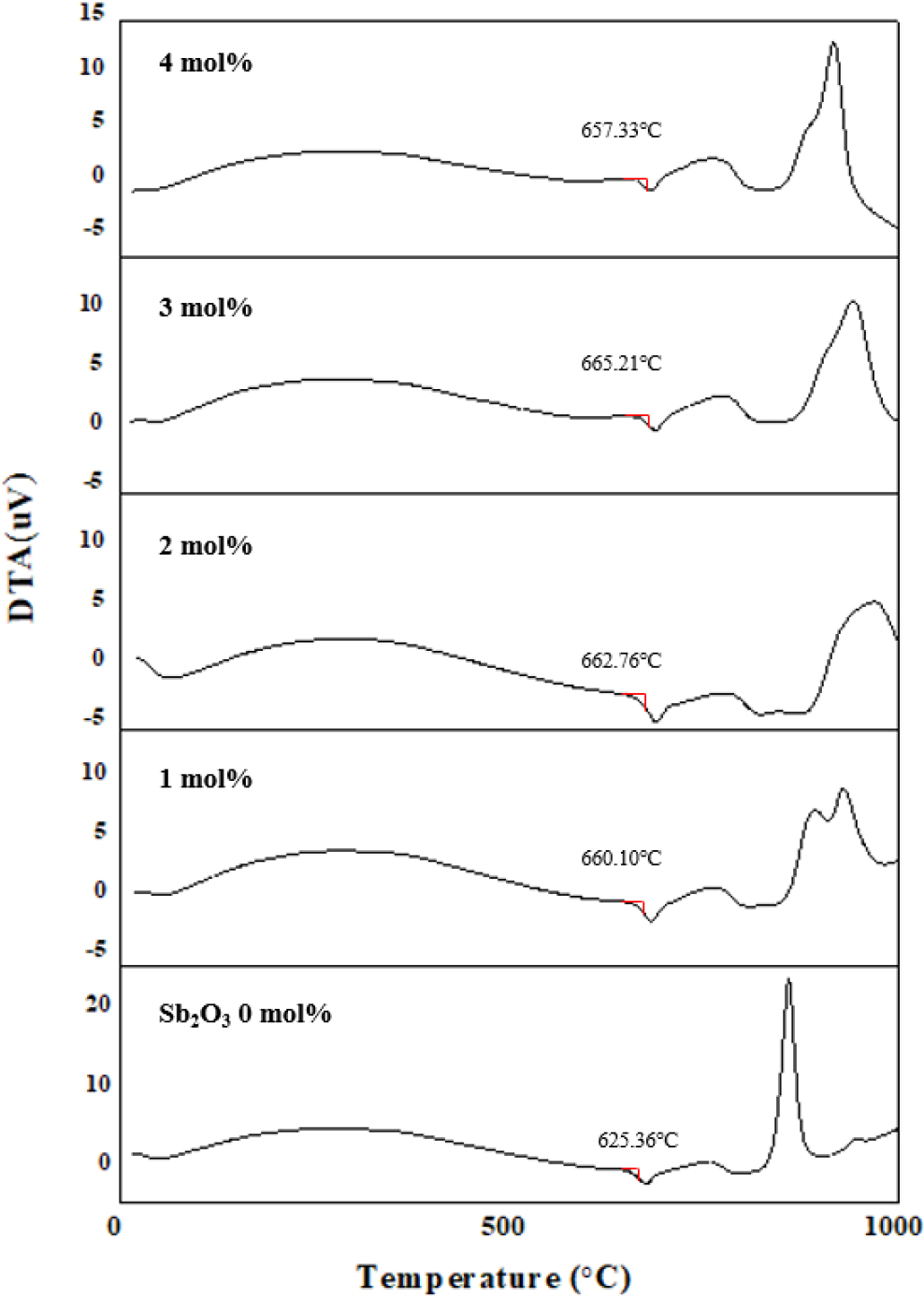
앞서 언급한 것처럼 몰드성형 공정 시 주어지는 성형온도로부터 발생하는 열적 스트레스를 줄이고 및 손쉬운 성형을 위해서는 유리전이온도가 가능한 낮을수록 몰드성형에 유리하다. 중금속 산화물계 유리에 안정화제로서 Sb2O3를 0~4 mol% 첨가하였으며, 용융-냉각법을 통해 제조된 중금속 산화물 유리의 유리전이온도 확인을 위해 TG-DTA 장비를 사용하여 측정하였으며, 그 결과를 Fig. 2에 나타내었다. 용융-냉각법을 통해 제조된 중금속 산화물 유리는 Sb2O3의 첨가량과 상관없이 모든 조성에서 질량 감소는 없는 것으로 확인되었다. 유리전이 온도는 Sb2O3의 첨가량이 적은 순서로 각각 659 °C, 660 °C, 662 °C, 665 °C 및 657 °C로 Sb2O3의 첨가량이 증가함에 따라 유리전이온도가 대체로 상승하는 경향을 보였다. Jo12)의 연구에 따르면 유리의 결정화 발열피크를 통해 유리의 안정성을 확인하였고, 발열피크의 상대강도가 높을수록 안정성이 높다고 설명하였다.12) 이와 같이 본 연구에서 중금속 산화물 유리의 안정화제로써 첨가한 Sb2O3는 그 첨가량에 따라 유리전이 이후에 발생하는 결정화 현상을 나타내는 발열피크의 상대강도가 변화하는 것으로 확인 되었고, 이는 Sb2O3가 용융유리 내에서 안정화제로 역할을 한다는 이론적 사실과 일치함을 알 수 있었다.13)
다만, TG-DTA 분석시 Sb2O3의 첨가량이 증가함에 따라 750 °C 부근에서의 발열피크의 세기가 증가하고 있으며, 발열피크 증가에 따른 결정화 대한 지속적인 연구가 필요하며 유리안정성을 높이기 위한 연구가 추후 필요하다 판단되었다.
Fig. 3은 용융-냉각법으로 제조된 16BaO-56GeO2-38La2O3-(20-x)ZnO-(x)Sb2O3계 유리의 각 조성 별 XRD 분석결과를 나타낸 것으로 Sb2O3 첨가량과 상관없이 모든 조성의 중금속 산화물 유리는 20~40º 범위에서 브로드한 비정질 피크가 확인되었는데, 이는 전형적인 HMO (중금속 산화물) 유리의 패턴을 보인다.14) Sb2O3가 3 mol% 이상 첨가될 경우 결정질 피크와 함께 비정질 피크의 상대강도가 약간 감소하였으며, 유리의 결정화로 인한 점도 상승 및 유백화 현상이 발생하였는데, 유리화 범위의 초과로 인하여 유리의 형성이 완전하지 않은 것으로 판단된다.
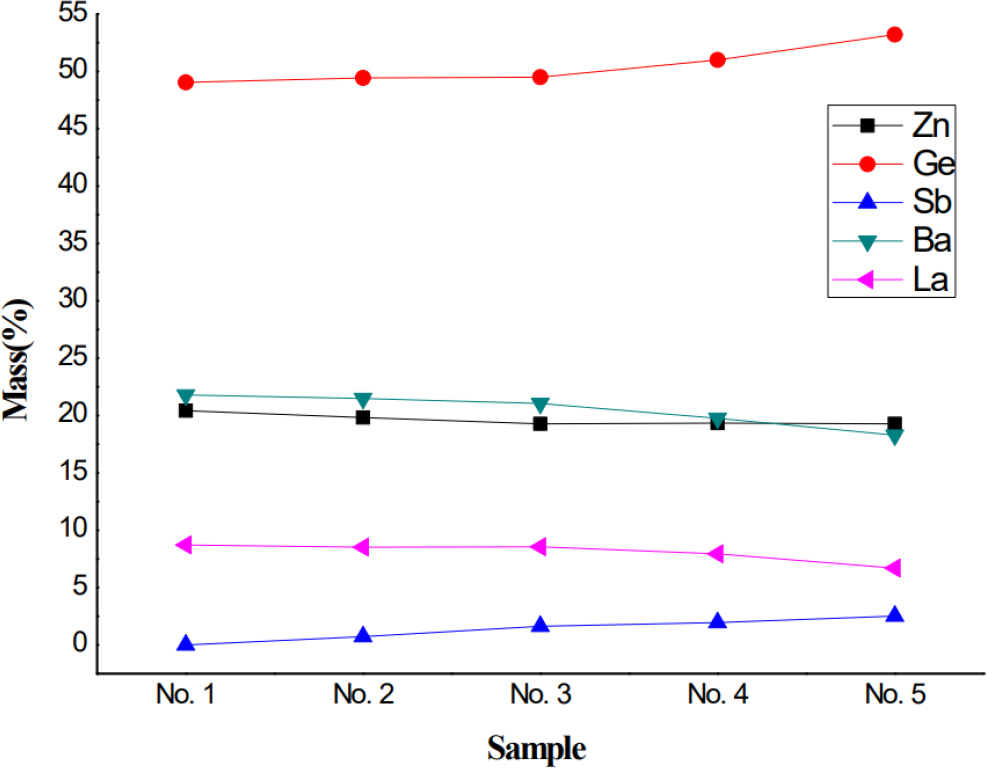
16BaO-56GeO2-38La2O3-(20-x)ZnO-(x)Sb2O3계 중금속 산화물(HMO) 유리 정량 및 균질화 상태를 확인하기 위하여 유리샘플을 분말화하여 XRF 분석을 실시하였으며, 그 결과를 Fig. 4에 나타내었다. 각 조성별로 3회 이상 측정하여 평균값을 제시하였으며, 첨가한 원료 La, Zn, Sb, Ge, Ba의 초기 첨가량에 비하여 유리 제조 후 실제 조성비에 차이가 있었다. 이러한 차이는 용융 시 끓는점이 낮은 원소들의 기화에 의한 실제 조성과의 차이 및 산소가 제외된 원소상태로 측정되어 발생한 것으로 판단된다. 조성 변수로서 Zn의 경우, 0, 1, 2, 3, 4 mol% 순으로 20.426, 19.820, 19.271, 19.334, 19.282로 Table 1의 조성비와 같이 감소하는 것을 확인 할 수 있었으며, Sb의 경우, 0, 1, 2, 3, 4 mol% 순으로 각각 0, 0.733, 1.631, 1.959, 2.515로 조성비와 같이 증가하는 것을 확인 할 수 있었다.
반면 조성 고정값인 Ge, Ba, La의 경우, 0, 1, 2, 3, 4 mol% 순으로 Ge 49.037, 49.424, 49.493, 51.003, 53.209로 증가하였으며, Ba 21.796, 21.494, 21.051, 19.764, 18.290로 감소하였고, La 8.721, 8.528, 8.554, 7.939, 6.704로 La 또한 감소하였음을 알 수 있었다. 이러한 결과로 인하여 Fig. 3의 XRD 결과 모든 조성에서 비정질의 피크가 확인되었고 이로 말미암아 Ge와 Ba에 의해 유리화가 가능한 것으로 보인다. Sb의 함량이 증가함에 따라 유리 내부의 망목구조에서 Sb원소가 수식제 역할을 함으로써, 형성된 망목구조를 절단하여 공동자리를 채움으로써, 유리의 안정성을 낮추고 결정화 반응성을 높인 것으로 보이며, Fig. 3의 Sb2O3의 첨가량 증가에 따른 결정질 피크와 함께 유백화 현상을 통해 중금속 산화물 유리의 결정화 현상을 확인할 수 있었다.
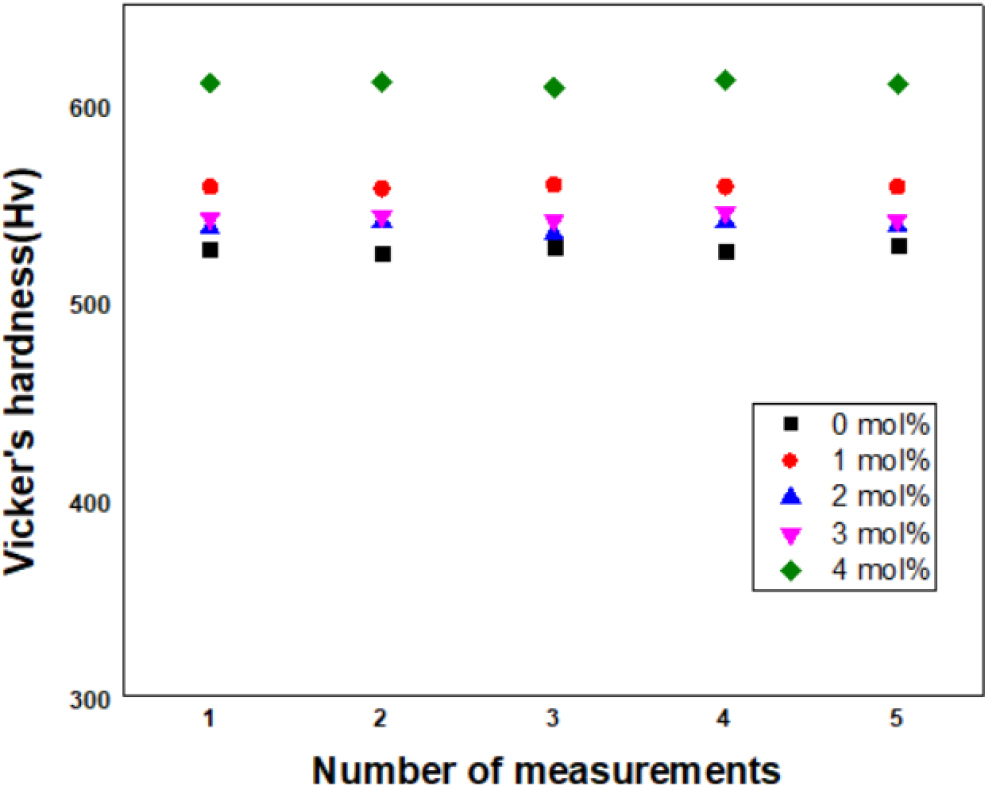
적외선 광학계에 쓰이는 ZnSe나 칼코게나이드 유리는 실리카 계열의 유리에 비하여 6배 정도 약한 경도를 가지고 있다.5) 렌즈가 외부의 긁힘이나 마모에 견딜 뿐만 아니라 광학계의 소형화를 위해서는 기계적 강도가 우수해야 한다. 비커스경도기를 사용하여 중금속 산화물계 유리의 경도를 측정한 결과를 Fig. 5에 나타내었는데, Sb2O3 첨가량에 따라 4 mol% > 1 mol% > 3 mol% > 2 mol% > 0 mol% 순으로 높은 경도를 보였다. Sb2O3 첨가량이 4 mol% 첨가된 경우 다른 조성에 비해 50 Hv 이상 높은 경도를 보였으며, 나머지 조성은 경도에서 10~20 Hv 내외로 큰 차이를 보이지는 않았다. Sb2O3 첨가량이 4 mol%로 과도하게 첨가된 경우 중금속 산화물 유리의 결정화로 인한 경도 상승 가능성이 있는 것으로 보인다. 일반적으로 ZnO가 Sb2O3로 치환하며 상대적인 결합강도에 의해 경도에 차이가 발생하게 된다.14) 결합에너지가 250 kJ/mol인 ZnO가 결합에너지 233 kJ/mol인 Sb2O3의 비율 변화에 따라 결합에너지가 상대적으로 크고 결합강도가 큰 ZnO의 결합수가 줄고 결합에너지가 상대적으로 작은 Sb의 결합 증가에 따라 경도가 감소하게 된다. 하지만, 본 연구에서 제조한 중금속산화물 유리의 경도에 영향을 주는 요소는 ZnO와 Sb2O3의 결합에너지 뿐만 아니라 다양한 요인이 작용하는 것으로 해석된다. 대표적인 예로 안정화제로 첨가한 Sb2O3에 의해 중금속 산화물계 유리의 안정화에 의한 맥리와 기포현상이 줄어들었고, 경도가 향상되는데 영향을 주었을 것이다. 또한 과도한 Sb2O3 양은 중금속 산화물 유리의 용융 시 점도상승에 의한 맥리와 기포현상을 증가시키고 결정화로 인해 중금속 산화물 유리의 경도에 다양한 변수가 작용할 것으로 보인다. 따라서 Sb2O3를 중금속 산화물 유리의 안정화제로써 맥리와 기포현상을 줄이고, 결정화가 되지 않은 범위에서 첨가량을 조절하여 중금속 산화물 유리의 특성을 개선하여야 할 것이다.
적외선 광학렌즈는 굴절율이 클수록 렌즈의 곡률반경을 크게 제작할 수 있다. 렌즈의 곡률반경이 클수록 수차가 상대적으로 작아지는데 이는 렌즈의 매수를 줄여 단가의 하락과 다양한 광학설계를 할 수가 있으므로 굴절율이 높아야 한다. 유리의 굴절율은 예측하기 위해서는 Lorentz-Lorenz’s 식5)이 주로 사용된다. 이는 분자굴절률(molecular refraction, R), 분자의 무게(m), 분자의 부피(V)를 이용하여 굴절률(n)을 표현한다. 아래 방정식에서 R/M은 몰 굴절률(molar refraction, RM), ρ은 밀도를 나타내며 반복 단위를 구성하는 구성요소들의 원자 및 원자군 굴절률의 합이다. 마찬가지로 M/V는 몰 부피(mole volume, VM)의 역수로 표현될 수 있다.15)
일반적으로 유리 내에 무거운 이온이 많이 존재할수록 유리의 굴절율은 증가하게 된다. 위와 같은 이론적 사실에 근거하여 본 연구에서는 모유리 유리안정성을 높이기 위하여 ZnO의 함량을 기존 20 mol%에서 16 mol%까지 감소시켰으며, 유리안정화제 특성을 가지고 있는 Sb2O3의 함량 변화에 따라 유리의 특성을 분석하였다. Fig. 6에서 확인할 수 있듯이 16BaO-56GeO2-38La2O3-(20-x)ZnO-(x)Sb2O3계 유리의 경우, Sb2O3의 함량이 0 mol%에서 4 mol%로 증가함에 따라 굴절율은 증가하였으며, 이러한 결과는 Lorentz-Lorenz’s 식에 의한 이론적 사실과 일치하는 것을 확인할 수 있었다.
용융-냉각법으로 제조된 중금속 산화물계 유리의 광투과율을 분광광도계를 사용하여 0.1~1 µm 파장범위의 광투과율을 측정하였고, Fig. 7에 그 결과를 나타내었다. 일반적으로 중금속 산화물계(HMO) 유리의 IR cut-off는 격자중심의 측면이동과 초점, 격자간 거리의 불일치에 의해 결정된다.16) 고체내의 결합이 약할수록, 원자량이 클수록 기초흡수의 주파수는 낮아지고 이에 따라 파장의 투과한계가 적외선 영역이 된다. Sb2O3의 약한 결합력은 근적외선 파장의 투과율 개선에 도움이 되지만 상대적으로 물리적 특성에 불리하다. Sb2O3를 3 mol% 및 4 mol% 첨가한 경우 근적외선 영역에서 각각 70 % 및 50 %의 투과율을 보였던 반면 그 외 모든 조성의 중금속 산화물 유리에서 가시광, 근적외선 파장의 투과율이 80 % 이상으로 확인되었다. Sb2O3의 첨가량이 증가함에 따라 가시광 및 적외선 파장의 투과율이 떨어지는 것은 앞선 결과와 같이 결정화로 인한 것으로 볼 수 있다. 빛은 매질이 달라지는 경계에서 반사와 굴절이 일어나며, 반사각은 입사각과 같고, 두 매질에서의 빛의 속도가 다르기 때문에 굴절이 일어난다. 굴절률이 큰 매질에서 굴절률이 작은 매질로 전달될 때, 스넬의 법칙에 따라 입사각이 어느 각도 이상이 되면 모든 빛이 반사되는 전반사가 일어난다. 이와 같이 투과율이 높은 유리 내부에 결정화가 발생하여, 빛이 투과하는 과정 중 결정질에 부딪히게 되면서 빛이 반사되어 자외선부터 가시광, 적외선까지 모든 영역에서의 투과율이 저하됨을 알 수 있었다.
80 % 이상의 투과율을 보였던 0 mol%, 1 mol%, 2 mol%의 Sb2O3를 첨가한 세 종류의 중금속 산화물 유리의 투과율이 0.8~0.9 µm 파장 부근에서 약간 감소하는 경향을 보이는데, 이는 해당 영역에서 OH 결합기의 흡수로 인하여 광투과율이 감소한 것으로 보여진다. 이는 Terashima13)의 연구와 같이 광투과율에 영향을 주는 요인으로 OH 결합기를 원인으로 보고 있으며, 해당 결과와 일치하는 것으로 판단된다.13) 중금속 산화물(HMO) 유리는 가시광선, 적외선 파장영역에서 광학적 특성 및 기계적 특성이 우수하지만, 앞서 언급한 비산화물계 조성에 비하여 대기 중의 OH 결합기나 CO2 결합기에 대하여 투과율이 저하되는 것이 단점이다. 때문에 중금속 산화물(HMO) 유리를 적외선 영역에서의 광투과율 안정성을 확보하기 위해서는 OH 결합기 제거를 위한 다양한 시도가 필요할 것이다.
위의 방법대로 제작한 16BaO-56GeO2-38La2O3-(20-x)ZnO-(x)Sb2O3계 중금속 산화물(HMO) 유리 샘플을 Fig. 8에 나타내었다. 가시적으로 확인한 결과 Sb2O3첨가량이 0, 1, 2 3, 4 mol%로 증가할수록 결정화에 의한 유리 샘플의 투명도가 저하됨을 알 수 있었다.
4. 결 론
본 연구에서는 적외선 렌즈용 중금속산화물계 유리의 제조 및 특성분석을 연구하였다. 용융-냉각법을 활용하여 중금속산화물(HMO)계 유리 제조과정과 GMP 몰드성형에서의 성형공정에 적용할 수 있는 적외선 렌즈용 소재로서 4원계 Ba ‧ Ge ‧ La ‧ Zn계 유리를 기본조성으로 유리 안정화제인 Sb를 0, 1, 2, 3, 4 mol%로 치환하는 조성으로 중금속 산화물 유리를 제조하였다. 몰드성형에 적합한 유리전이온도, 유리화 가능성, 광투과율, 굴절율, 경도 등을 만족하는 조성비 확립을 위해 기존 연구와 삼성분계 다이어그램을 활용하여 유리화 가능성을 확인하였고, 이를 바탕으로 16BaO-56GeO2-38La2O3-(20-x)ZnO-(x)Sb2O3계 유리의 최적 조성비를 결정하였다.
Sb2O3를 0, 1, 2, 3, 4 mol% 순으로 첨가하였을 시 유리형성가능성을 고찰하였으며, 유리형성가능성의 경우, 혼화성 매개변수 Kgl = (Tc-Tg) / (Tm-Tc)로 정의할 수 있다. Kgl 계수가 클수록 유리형성 가능성이 높아진다. Sb2O3를 0, 1, 2 mol% 첨가한 샘플의 경우, 혼화성계수가 높아 더 많은 가교결합과 네트워크의 밀집패킹으로 인하여 유리전이온도를 높이고 경도를 증가시키는 효과를 보였다. 반면 3, 4 mol% 첨가한 샘플의 경우, Sb원소가 수식제 역할을 함으로써, 형성된 결합을 절단하여, 공동자리를 채움으로써, 비혼화성으로 인한 결정화반응을 높여 유백색의 결정질을 생성하여 투과율 감소에 영향을 준 것으로 생각된다.
과도한 Sb2O3의 첨가량은 오히려 GMP 몰드성형에 불리한 것으로 보이지만, 적절한 양의 Sb2O3가 첨가될 경우 중금속 산화물 유리의 안정성 및 특성개선을 통해 GMP 몰드성형이 가능한 적외선 렌즈 소재로서 적용 가능성이 높은 것을 확인 할 수 있었다. 본 연구에서는 1 mol%의 Sb2O3가 첨가된 16BaO-56GeO2-38La2O3-(20-x)ZnO-(x)Sb2O3계 유리가 가장 GMP 성형에 유리하며, 그 외 투과율, 굴절율 및 경도와 같은 특성에서 각각 80 % 이상, 1.810, 558 Hv로 가장 우수한 결과를 도출 할 수 있었다.