1. 서 론
우수한 열적, 화학적 내구성을 가지는 알루미나(Al2O3) 재료는 반도체 제조공정 중 고온 플라즈마 환경의 확산 공정(diffusion process), 화학 증착 공정(CVD process), 식각 공정(etching process) 장비 내부에 사용되고 있다.1,2) 근래 반도체의 집적도가 높아짐에 따라 선 폭 미세화를 위해 식각 공정의 플라즈마 강도가 점점 강해지고 있어 높은 플라즈마 내구성을 가지는 알루미나 소재 및 부품 개발의 중요성이 가중되고 있다.
플라즈마에 의한 알루미나의 식각은 2단계 과정으로 나타나는데 먼저 불소와의 반응으로 인한 표면 불소화단계와 이후 불소화층의 물리적 제거단계로 발생한다고 보고되었다.3,4) 알루미나 소결체의 경우 기공 및 순도와는 무관하게 유사한 평균 식각속도를 나타내는데 미시적으로 소결체 내의 기공과 같은 결함이나 불순물로 인한 유리상이 플라즈마 식각이 집중적으로 발생하는 지점으로 나타난다. 따라서 플라즈마 식각이 진행되는 과정에서 치밀한 미세구조와 높은 순도의 알루미나 소결체는 오염입자의 발생 가능성을 낮출 수 있다.
주입성형(slip casting) 공정기술은 다공성 몰드(mold)에 세라믹 슬러리(slurry)를 주입하여 다양한 조성과 형상의 부품을 성형하는 방법으로 낮은 설비투자비용 대비 복잡 형상 및 대형화에 유연하게 대응할 수 있다는 장점을 가지고 있다.5,6,7) 이로 인해 세라믹 제조공정에 보편적으로 적용되고 있으며, 단순이 석고몰드를 사용하던 초기 기술로부터 대형 세라믹 판재 생산용 필터 프레스(filter press) 방식, 복잡한 형상제조 및 공정시간을 단축하기 위해 레진 몰드를 이용한 고압 주입 방식(high pressure casting), 압력과 진공을 동시에 가해주는 하이브리드 방식, 경사 미세구조 구현을 위한 원심분리 또는 급속 냉각 방식 등 기술의 발전이 지속적으로 이루어지고 있다.
세라믹 분말과 용매를 혼합한 슬러리를 다공성 몰드의 삼투압을 이용해 성형하는 주입성형 공정의 핵심은 세라믹 슬러리 물성 제어와 몰드 제조 기술에 있다.8,9,10) 내플라즈마 세라믹 부품 제조를 위해 몰드 소재 및 구조가 결정되면 강도를 제한하는 결함을 제거하고 소결공정중 낮은 수축률과 열간 변형을 나타내도록 저점도 ‧ 고충진 세라믹 슬러리 제조가 필수적이다. 이를 위해서는 용매 내에서 세라믹 분말간의 상호작용을 이해하고 슬러리의 안정성을 분석 ‧ 제어하는 것이 중요한다.
본 연구에서는 3종의 알루미나 분말 특성을 분석하고 이를 이용하여 제조한 슬러리의 점도 및 침전거동을 분석하였다. 현재 반도체 장비용 세라믹 부품제조 분야에서 일본 스미토모(Sumitomo)사 알루미나 분말은 기술 표준으로 인식되고 있으며 프랑스 알테오(Alteo)사 분말은 대체품으로 인식되고 있다. 이 두 제품을 대체하기 위해 최근 국내 개발한 알루미나 분말 시제품을 선택하여 비교분석을 진행하였다. 3종 분말이 가지는 물리 ‧ 화학적 특성이 슬러리의 유변학적 특성에 미치는 요소들을 확인하고 분산 안정성을 가지는 고농도의 슬러리를 제조하기 위한 분말의 특성과 슬러리의 분산조건을 확인하였다.
2. 실험 방법
실험에 사용한 α-Al2O3 분말은 AES-11 (Sumitomo, Japan), P-162 (Alteo, France), ALG-1SH (Daehan Ceramics, Korea) 3종이었다. ALG-1SH 분말은 γ-알루미나를 열처리하여 개발한 제품으로 현재 시제품 평가단계에 있다.
Inductively Coupled Plasma Spectroscopy (ICP, Optima 5300DV, PerkinElmer, USA)를 이용하여 분말의 화학성분을 분석하였다. He-pycnometer (AccuPycIII 1340, Micromeritics, USA)와 비표면적 측정기(Tristar, Micromeritics, USA)를 이용하여 알루미나 분말의 밀도와 비표면적을 측정하였다. 분말을 110 °С 오븐에서 24시간 완전 건조 후 밀도(5회)와 비표면적(3회)을 측정하여 평균값을 보고하였다. 레이저 방식 입도 분석기(Laser Scattering Particle Size Distribution Analyzer, LA-950V2, Horiba, Japan)를 이용하여 분말의 입도분포를 측정하였다. 고형분 10 wt% 슬러리에 분산제(Cerasperse CF5468, Sannopco Korea, Korea) 0.5 wt%를 첨가하여 저농도의 슬러리를 제조하였다. 자석 교반기를 이용하여 3시간 동안 혼합한 후 초음파를 이용하여 30초 간격으로 3회 반복하여 분산시킨 후 입도분포를 측정하였다.
XRD (X-ray diffraction, Dmax-2500, Rigaku, Japan)를 이용하여 분말의 결정상 분석을 실시하였다. 3종 알루미나의 이온용출 특성을 분석하기 위하여 고형분 30 wt% 비율로 증류수와 혼합하여 24시간 볼밀링 후 원심분리기(1580R, Labogene, Korea)를 이용하여 상청액을 분리하였다. 분리한 상청액을 다시 필터링(Syringe Filter, Hyundai Micro, Korea)한 후 pH와 전기전도도를 측정하고 ICP를 이용하여 성분분석을 실시하였다.
Debye Hückel parameter의 역수로 전기이중층의 두께를 계산하였다. 여기서, L: 전기이중충두께(nm), κ: Debye Hückel parameter, c: 카운터 이온 농도, z: 카운터 이온 전하를 나타낸다.
분산제 첨가량에 따른 알루미나 슬러리의 점도 변화를 확인하기 위하여 고형분 50 wt% 슬러리에 0.0~1.0 mg/m2 범위에서 0.2 mg/m2 간격으로 분산제를 첨가하여 점도를 측정하였다. Cup & Bob (coaxial cylinders) 타입의 측정 장치(Anton Paar, Austria)를 이용하여 일정한 온도(25 °С)에서 실험을 진행하였다. 정상 상태 모드로 전단율 10-4~103 s-1 구간에서 점도를 측정하였다. 슬러리의 분산 안정성 분석을 위해 Turbiscan LAB stability analyzer (Formulaction SA, France)를 이용하였다.
3. 결과 및 고찰
알루미나 분말 3종의 화학성분 분석결과를 Table 1에 정리하였다. 세 가지 분말 모두 99 wt% 이상의 순도를 나타내었으며, P162 분말이 99.60 wt%로 가장 높은 순도를 나타내었다. 3가지 분말 모두에서 SiO2 성분은 0.14~0.21 wt%, Na2O 성분은 0.04~0.15 wt% 범위에서 나타났다. AES-11과 P162 분말은 bauxite를 이용해 Bayer 공정으로 제조하며, ALG-1SH는 γ-알루미나로부터 시작하여 분말을 제조하였다.11,12,13) 따라서 SiO2와 Na2O 성분은 bauxite로부터 유래하거나, 가소소다를 제거하는 탈소다 공정에서 사용하는 실리카질 첨가제와 완전히 제거하지 못한 Na2O 잔여물로 인해 나타나는 것으로 보인다,14) 소결 첨가제로 사용하는 MgO 성분은 0.03~0.12 wt%로 나타났다.15)
Table 1.
Chemical composition of Al2O3 powders under investigation.
Table 2에 분말의 밀도, 비표면적, 입도분포를 비교하였다. 밀도는 ALG-1SH (3.76 g/cm3), AES-11 (3.73 g/cm3), P162 (3.69 g/cm3) 순으로 나타났으며, 비표면적은 ALG-1SH (6.4 m2/g), AES-11 (6.28 m2/g), P162 (5.43 m2/g) 순으로 나타났다. 3종 분말들의 D10, D50 값은 유사하였으나 D90 값은 차이를 보였다. ALG-1SH의 D90이 1.14 µm로 가장 높게 나타났으며 이를 반영하여 평균 입도는 ALG-1SH (0.52 µm), P162 (0.47 µm), AES-11 (0.37 µm) 순이었다. 분말의 입도분포를 Fig. 1에 나타내었다. AES-11에 비해 P162와 ALG-1SH의 입도분포가 0~2 µm 사이에서 넓게 나타났으며 P162 분말의 경우 이봉에 가까운 입도분포를 나타내었다. AES-11 분말은 상대적으로 균일한 단봉 입도분포를 나타내었다.
Table 2.
Density, specific surface area and particle size distribution of Al2O3 powders.
| Sample ID | AES-11 | P162 | ALG-1SH |
| Density (g/cm3) | 3.73 | 3.69 | 3.76 |
| Specific surface area (m2/g) | 6.28 | 5.43 | 6.4 ± 0.6 |
| D10 (µm) | 0.14 | 0.11 | 0.13 |
| D50 | 0.27 | 0.29 | 0.28 |
| D90 | 0.7 | 1.01 | 1.14 |
| Mean (µm) | 0.37 | 0.47 | 0.52 |
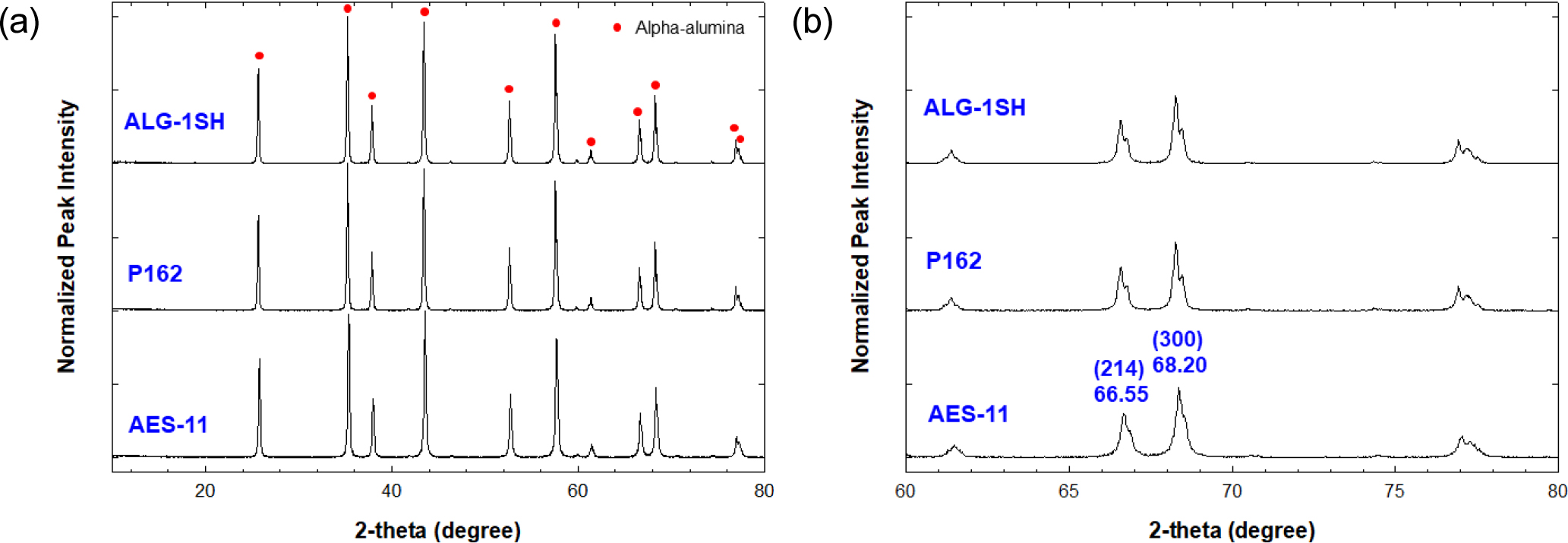
α-알루미나가 주상을 이루는 3종 분말의 결정상 분석결과를 Fig. 2에 나타내었다. Fig. 2(b)에는 α 상의 (214), (300) 피크 위치에 해당하는 2θ = 60~80° 부분을 확대하여 나타내었다. ALH-1SH와 P162 분말은 2θ = 66.55, 68.20 부근에서 각각 2개의 피크가 겹쳐져 나타났으나 AES-11의 경우 하나의 피크가 상대적으로 약해 완만한 형상의 피크가 나타났다. 이 2θ 위치에서 나타나는 2개의 피크들은 α-상 이외의 소상이 존재함을 나타내고 있다.16) 대부분의 sub α-알루미나 상들은 66.55°에서 나타나는 피크에 영향을 미치며, β-상만이 68.20°에서 나타나는 피크에 영향을 미치는 것으로 알려져 있다. 그러므로 여기서 나타나는 소상은 β 상에 기인한 것으로 보인다.
Na2O 농도로부터 화학 양론적으로 β 상 Na2O-11Al2O3의 농도를 계산하였다. Na2O-11Al2O3는 Bayer 방식으로 제조하는 알루미나 분말에서 나타나는 불순물로서 물에 쉽게 용출되는 것으로 알려져 있다.17) 3종 분말의 β 상 Na2O-11Al2O3 농도는 다음과 같았다: AES-11 (2.56 %), P162 (0.78 %), ALG-1SH (2.83 %). AES-11과 ALG-1SH 분말은 상대적으로 높은 불순물 함량을 나타내었다.
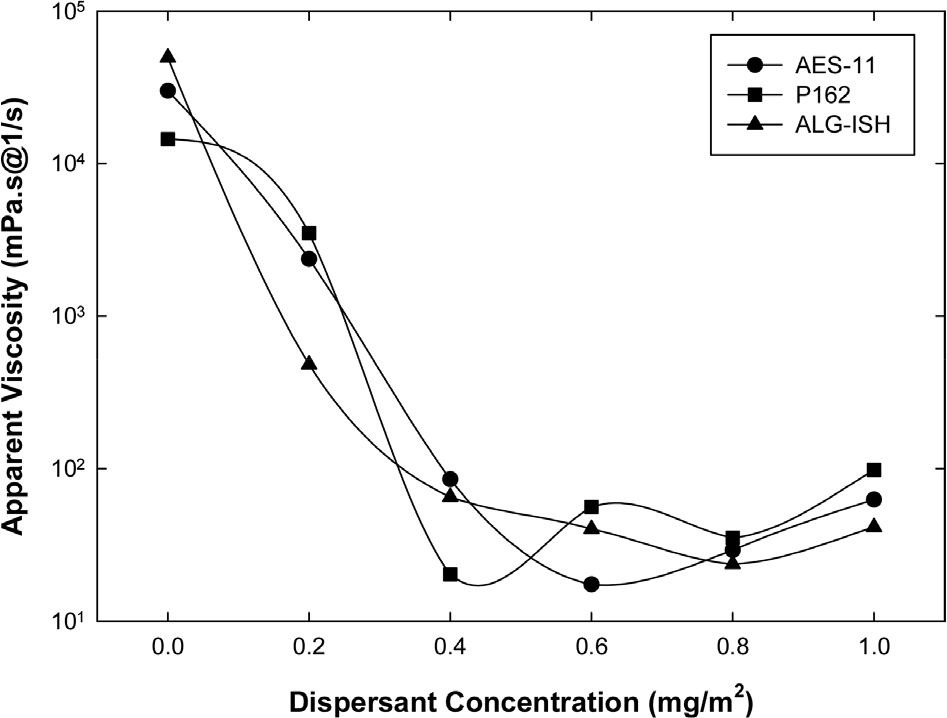
분산제 첨가에 따른 알루미나 슬러리의 점도 변화를 관찰하기 위하여 고형분 50 wt% 슬러리에 0.0~1.0 mg/m2 범위에서 0.2 mg/m2 간격으로 분산제를 첨가하여 점도를 측정하였다. Fig. 3에서 보이듯이 분산제를 첨가하지 않은 상태에서 3가지 슬러리는 모두 매우 높은 점도 값(>10,000 mPa ‧ s)을 나타냈으며 분산제 첨가에 따라 점도 값이 급격히 감소하는 것을 볼 수 있다. AES-11, P162, ALG-1SH는 각각 0.4, 0.6, 0.8 mg/m2 분산제 첨가량에서 가장 낮은 점도 값을 나타내었다.
분산제를 첨가하지 않은 상태에서 ALG-1SH 알루미나 슬러리는 가장 높은 점도 값을 나타냈으며 상대적으로 점도 변화가 완만하게 나타났다. 물성분석 결과를 고려할 때 AES-11가 가장 높은 점도를 보일 것으로 예상되었으나 상대적으로 큰 평균입도를 가지는 ALG-1SH가 가장 높은 점도를 나타내었다. 이러한 결과는 분말의 이온용출 특성과 상관이 있는 것으로 보여진다. 알루미나의 이온용출 거동을 확인하고자 슬러리로부터 상청액을 분리하여 pH와 전기전도도를 측정하고 성분분석을 실시하였다(Table 3). 상청액은 모두 pH = 9.8 이상으로 유사하였으나 전기전도도는 분말에 따라 차이가 나타났다. 특히 ALG-1SH의 경우 1,491 µs/cm로 다른 알루미나 대비(AES-11 656.3, P162 384.7 µs/cm) 2배 이상 높게 나타났다. 이것은 ALG-1SH 분말의 이온 용출 특성이 매우 높다는 것을 간접적으로 의미한다.
Table 3.
pH and electrical conductivity of supernatants separated from Al2O3 slurries.
| Sample ID | AES11 | P162 | ALG-1SH |
| pH | 9.81 | 9.87 | 9.85 |
| Electrical conductivity (µs/cm) | 656.3 | 384.7 | 1,491 |
Table 4에 상청액의 성분분석 결과를 나타내었다. 전체 이온 용출량은 AES-11 (170.48 mg/L), P162 (113.37 mg/L), ALG-1SH (256.08 mg/L)로 나타났다. 3종의 알루미나에서 모두 Na+ 이온 용출이 가장 높게 나타났다. ALG-1SH의 경우 가장 높은 Na+ 이온 용출을 보였으며 다른 분말들과는 다르게 S의 용출이 나타났다. Na+ 이온 용출량은 위에서 계산한 beta 상 Na2O-11Al2O3의 농도와 연관성을 가지는 것으로 보여진다. AES-11의 경우 Na+와 더불어 Al3+ 이온의 용출이 다음으로 높게 나타났으며, P-162의 경우 Na+-K+-Al3+ 이온 순으로 용출이 나타났다. Al3+ 이온은 알루미나 입자들의 표면으로부터 용출될 수 있는 것으로 보고되었다.18,19)
Table 4.
Chemical composition of supernatants separated from Al2O3 slurries.
위의 상청액에서 분석한 이온 용출량과 Debye Hückel parameter를 이용하여 분산제를 첨가하지 않았을 때 용매 내 분말의 전기이중충 두께를 계산하였다. P162 (5.5 nm), AES-11 (4.54 nm), ALG-1SH (4.41 nm)로 나타났다.20) 용출 이온들은 전기이중층을 압박하여 분말들의 응집을 유발하는 것으로 알려져 있다. 슬러리내 분말들이 응집하면 점도는 증가하고 성형체의 밀도는 감소하는 것으로 보고되었다.21,22,23) 이 결과로부터 유사한 물성(입도 및 비표면적)을 가지는 분말들의 경우 가장 작은 전기이중층 두께를 나타내는 슬러리가 가장 높은 점도를 보이는 것으로 판단하였다.
분산제인 폴리카복실레이트(polycarboxylate)는 수계 공정에서 알루미나를 분산시키는데 매우 효과적인 것으로 알려져 있다.24) 폴리카복실레이트는 알루미나 입자 표면에 흡착하여 전체 계의 에너지를 낮추어 주며 입자의 표면이 모두 중합체로 덮일 경우 같은 전하를 띠는 입자들을 밀쳐내기에 충분한 전하를 띠게 된다. 그러나 입자의 표면이 일부분만 덮이게 될 경우 입자들은 반 데르 발스 인력에 의해 응집이 발생한다. 따라서 분말 별로 가장 낮은 점도를 나타내는 분산제 첨가량에서 입자들의 표면이 모두 폴리카복실레이트로 덮여 충분한 반발력을 나타내는 상태라고 할 수 있다.
알루미나 슬러리의 분산 안정성 분석을 위해 가장 낮은 점도 값을 나타내는 슬러리를 이용해 침전거동을 분석하였다. Turbiscan 측정을 위해 원통형 유리 셀과 근적외선 880 nm 단일파장을 광원으로 사용하였다. 탐지기의 측정 방식은 투과율(%)과 반사율(%)이 있지만 측정 시 산란되는 빛으로 인해 반사율(%) 프로파일을 이용해 측정을 진행하였다.
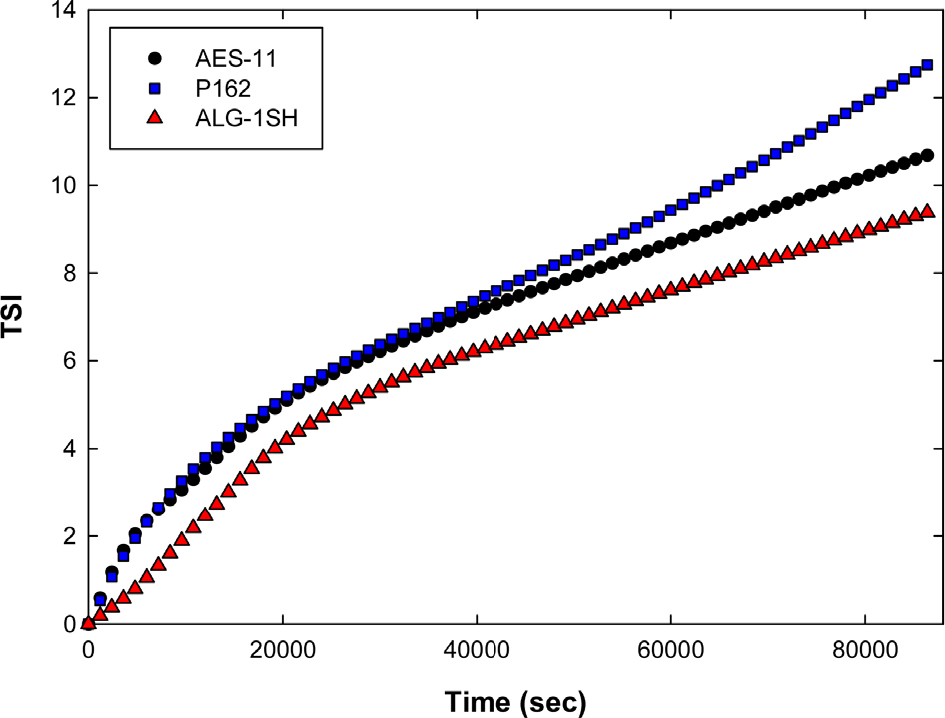
TSI 값은 침전과 같은 슬러리의 불안정한 거동을 반영하는데 ALG-1SH가 낮은 TSI 값을 보여 상대적으로 느리게 침전하는 것으로 알 수 있다(Fig. 4). AES-11과 P162의 경우 25,000 s 까지 유사한 거동을 보이다 이후에는 P162의 침전이 더 빠르게 나타나는 것을 불 수 있다. 이것은 분말의 분산이 적절하게 이루어질 때 침전거동은 입도의 영향을 받는 다는 것을 보여주는 결과이다. P162의 경우 AES-11에 비해 상대적으로 큰 입자들을 포함하고 있어 시간이 지남에 따라 이러한 입자들의 침전이 발생한다.
유리 셀에서 시료의 높이에 따라 상-중-하층으로 나누고 각 층에서의 반사율 프로파일 변화로 슬러리의 분산 안정성을 확인하였다(Fig. 5). 3종의 알루미나 슬러리 모두 상층부에서는 Rayleigh diffusion 현상이 발생하여 반사율이 급격하게 증가하는 정화(clarification) 모양을 나타냈다. 입자 크기가 광원의 파장보다 작을 때(<0.5 µm) Rayleigh diffusion 현상이 발생하게 되는데, 이 경우 작은 입자들 간의 간격이 좁아지면서 빛과 입자 간의 산란 확률이 높아지고 이에 따라 반사율(%) 값은 증가하게 된다.25,26) 중층과 하층부에서 시간에 따라 반사율이 작게 증가하는 것은 상대적으로 약한 응집과 침전 현상이 나타난다는 것이다.
P162는 AES-11, ALG-1SH과는 상층부에서 다른 침전거동을 보이고 있는데 이는 입도분포의 특성을 반영하는 것으로 보인다. 위에서도 기술한 바와 같이 P162의 경우 상대적으로 이봉 형태의 입도 분포를 가지는데 이로 인해 상층부에서 큰 입자들의 침전이 지속적으로 크게 발생하여 다른 분말들과 비교하여 높은 반사율이 나타나는 것으로 보인다.
4. 결 론
본 연구에서는 세 가지 알루미나(Al2O3) 분말의 화학적 특성, 물성, 결정상, 그리고 분산 안정성에 대한 종합적인 분석을 수행하였다. P162 분말이 99.60 wt%의 가장 높은 순도를 나타내었으며, 결정상 분석을 통해 모든 분말에서 베타(β) 상 Na2O-11Al2O3이 분순물로 존재함을 확인하였다.
세 분말 간의 밀도, 비표면적, 입도 분포 등의 차이가 나타났다. 특히, ALG-1SH의 경우 입도분포가 넓게 나타나고, P162는 이봉 형태를 가지며, AES-11은 균일한 단봉 입도분포를 보였다. 분순물로 인해 수계 슬러리 상태에서 Na+ 이온 용출이 가장 높게 나타났으며 이온 용출량은 불순물 함량과 비례하였다.
분산제가 첨가되지 않은 알루미나 슬러리의 경우 용출되는 이온들로부터 전기이중충 두께가 영향을 받아 점도의 차이가 나타났다. 분산제 첨가에 따른 슬러리의 점도 변화를 조사하여, 폴리카복실레이트가 분산 안정성을 향상시키는 데 효과적임을 확인하였다. 분산 안정성 분석에서는 ALG-1SH가 낮은 TSI 값을 보여 가장 느리게 침전하는 경향을 보였고, P162는 입도 분포의 영향으로 침전이 더 빠르게 나타났다.
이 연구는 다양한 물성 및 화학적 특성을 고려하여 알루미나 분말 간의 차이를 설명하고, 분산제가 분말의 분산 안정성에 미치는 영향을 탐구하였다. 이러한 결과는 산업적인 응용 분야에서 적절한 알루미나 분말을 선택하고 처리하기 위한 중요한 정보를 제공할 것으로 기대된다.